
| n |
| V |


科目:高中化学 来源: 题型:

| 稀H2SO4 |
| △ |
| 一定条件 |
| (Ⅰ)浓H2SO4 |
| 170℃ |
| 试剂X |
| (Ⅱ) |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2KClO3
| ||||
B、3CO+Fe2O3
| ||||
C、3Mg+2NH3
| ||||
| D、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 阅读材料,选择合适的方法把下列混合物按要求分离.
阅读材料,选择合适的方法把下列混合物按要求分离.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| 乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以 任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
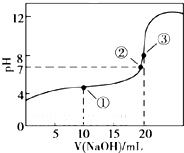 常温下,用0.1mol/L溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图.下列说法正确的是( )
常温下,用0.1mol/L溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图.下列说法正确的是( )| A、滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| B、点①所示溶液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C、点②所示溶液中c(CH3COOH)>c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
| D、点③所示溶液中c(Na+)+c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com