
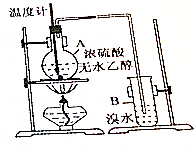
 已知乙醇与浓硫酸加热到170℃时可生成乙烯:
已知乙醇与浓硫酸加热到170℃时可生成乙烯:分析 实验室制取乙烯的原理是CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,由于为液体的反应,且加热,为防止液体暴沸,应加入碎瓷片,实验发现升温过程中A烧瓶内液体渐渐变黑,乙醇被碳化,且与浓硫酸发生氧化还原反应生成二氧化硫,乙烯和二氧化硫都可与溴水反应,其中二氧化硫表现还原性,以此解答该题.
解答 解:(1)纯液体加热容易暴沸,一般需要加入碎瓷片或沸石防暴沸,故答案为:碎瓷片或沸石;防止液体暴沸;
(2)①根据甲的观点,溴水可以使B中溶液褪色,发生加成反应,反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br;加成反应;
②乙根据现象认为产生了SO2,在B中溴单质可以和二氧化硫发生氧化还原反应,二氧化硫表现还原性,故答案为:还原性.
点评 本题考查实验室制取乙烯的装置及乙烯的性质,为高频考点,侧重于学生的分析、实验能力的考查,难度不大,只要把握住实验室制取乙烯的原理.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
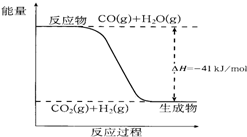 已知一氧化碳与水蒸气反应过程的能量变化如图所示:
已知一氧化碳与水蒸气反应过程的能量变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
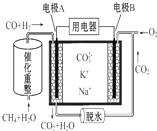
| A. | CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3 H2+CO,1 mol CH4参加反应转移12 mol电子 | |
| B. | 电极A为正极 | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | O2在B电极上被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaOH溶液中含Na+数目为0.1NA | |
| B. | 标准状况下,2.24L乙酸中含碳原子数目为0.2NA | |
| C. | 12gC60中含质子总数为6NA | |
| D. | 0.1molCl2与足量NaOH溶液反应,转移电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应属于加成反应 | |
| B. | 水杨醛能被酸性高锰酸钾溶液氧化为水杨酸 | |
| C. | 可用新制的Cu(OH)2悬浊液区别水扬醛和香豆素 | |
| D. | 水杨醛、乙酸肝和香豆素都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
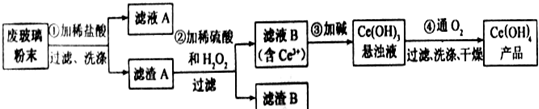
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向1ml 1mol/L的NaOH的溶液中滴加1~2滴2mol/LMgCl2溶液有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,出现红褐色沉淀,则证明Mg(OH)2的Ksp大于Fe(OH)3 | |
| B. | 由pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后的溶液显酸性 | |
| C. | 由0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后的溶液显酸性 | |
| D. | 某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7,则该溶液的pH一定为14-a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试 管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30s | 2s |
| 试 管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100s | 90s |
| 试 管 | 滴入10滴稀硫酸的试管 | 加入1mL稀硫酸的试管 | 加入2mL稀硫酸的试管 |
| 褪色时间 | 70s | 100s | 120s |
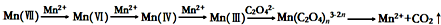
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com