
下列离子方程式中正确的是
A. 将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
B. 向FeBr2溶液中通入过量Cl2:2Fe2++4Br-+2Cl2=2Fe3++2Br2+4Cl-
C. 向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
D. NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
科目:高中化学 来源:2016届浙江省瑞安市四校高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列有关物质制备说法不正确的是
A.电解饱和食盐水制得金属Na
B.电解熔融MgCl2制得金属Mg
C.高温下CO还原赤铁矿可用于炼铁
D.高温下焦炭还原二氧化硅制得粗硅
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上期中测试化学试卷(解析版) 题型:计算题
(10分)某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程。流程中的滤液经过多次循环后用来后续制备氧化铁粉末。
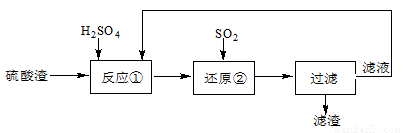
(1)为了加快反应①的反应速率,可采用的措施是 。(写出一点即可)
(2)“还原”是将Fe3+转化为Fe2+。在温度T1 、T2(T1 >T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如右所示。得出结论:该反应的温度不宜过高。

①通入SO2气体“还原”时, 试解释pH下降的原因是 。
②相同时间内,T1温度下溶液的pH更高的原因是 。
(3)该流程中循环使用的物质是 。
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量。实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00 mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00 mL。有关反应方程式如下:
2Fe3++2I-=2Fe2++I2;2Na2S2O3 + I2 = Na2S4O6 + 2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上期中测试化学试卷(解析版) 题型:选择题
下列关于氧化物的叙述正确的是
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.碱性氧化物一定是金属氧化物
C.碱性氧化物都能与水化合生成碱
D.酸性氧化物都能一定是非金属氧化物
查看答案和解析>>
科目:高中化学 来源:2016届福建省大田市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+
C.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古赤峰市宁城县高三上学期第一次统考化学试卷(解析版) 题型:选择题
在下列指定条件的溶液中,一定能大量共存的离子组是
①K2S溶液中:SO42﹣、K+、Cl﹣、Cu2+
②水电离的c(H+)水=1.0×10﹣13mol·L﹣1的溶液中:AlO2﹣、K+、SO42﹣、Br﹣
③pH=1的溶液中:K+、Fe2+、I﹣、Br﹣
④与铝反应产生大量氢气的溶液中:Na+、K+、NH4+、NO3﹣
⑤无色溶液中:Fe2+、Na+、ClO﹣、Cl﹣
⑥能使pH试纸呈红色的溶液中:Na+、NH4+、I﹣、NO3﹣
⑦滴入KSCN溶液显血红色的溶液中:K+、Na+、SO42﹣、C6H5OH
⑧室温下,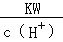 =0.1mol·L﹣1的溶液中:Na+、K+、SiO32﹣、NO3﹣.
=0.1mol·L﹣1的溶液中:Na+、K+、SiO32﹣、NO3﹣.
A.④⑦ B.②③④ C.③⑧ D.①⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期第一次月考化学试卷(解析版) 题型:选择题
设NA为阿佛加德罗常数的数值,下列说法正确的是
A.常温常压下,8gO2含有4NA个电子
B.1L1mol/L的K2SO4中有NA个K+
C.标准状况下,22.4L盐酸含有NA个HCl分子
D.1molNa被完全氧化生成Na2O2,失去2NA个电子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期半期考试化学试卷(解析版) 题型:选择题
下列推论正确的是
A.S(g)+O2(g)===SO2(g) ΔH1;S(s)+O2===SO2(g) ΔH2,则ΔH1>ΔH2
B.C(石墨,s)===C(金刚石,s) ΔH=+1.9kJ·mol-1,则金刚石比石墨稳定
C.OH-(aq)+H+(aq)= H2O(l) ΔH=-57.4kJ·mol-1,则:含20gNaOH的稀溶液与过量稀醋酸完全反应,放出的热量为28.7kJ
D.2C(s)+O2(g)===2CO(g) ΔH=-221kJ·mol-1,则碳的燃烧热大于110.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上期中测试化学试卷(解析版) 题型:计算题
制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。完成下列计算:
(1)CaCO3质量分数为0.90的石灰石100kg完成分解产生CO2 L(标准状况下)。
(2)石灰窑中,该石灰石100kg与焦炭混合焙烧,产生CO2 29120L(标准状况下),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为 mol。
(3)已知粗盐水含MgCl2 6.80mol/m3,含CaCl2 3.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,然后加入Na2CO3除钙离子。处理上述粗盐水10m3,至少需要加Na2CO3 g。
(4)如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2++2NH3+CO2+H2O=CaCO3↓+2NH4+。处理上述10m3粗盐水至少需要通入 L(标准状况下)碳酸化尾气。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com