
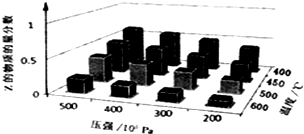
 为了探究外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.以下判断正确的是( )
为了探究外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.以下判断正确的是( )| A、△H>0,a+b>c |
| B、△H>0,a+b<c |
| C、△H<0,a+b>c |
| D、△H<0,a+b<c |


科目:高中化学 来源: 题型:
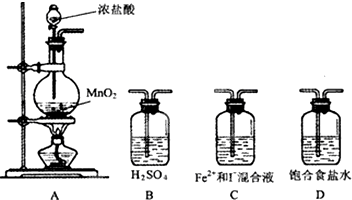 某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.
某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加 向B试管中滴加 | ①若 ②若 ③若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O |
| B、用硫酸酸化的桔红色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O |
| C、用氯酸钠的酸性溶液与H2O2作用制取ClO2:2ClO3-+H2O2+2H+=2ClO2↑+O2↑+2H2O |
| D、碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-=NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 750℃ |
| 750℃ |
| 物质 | 溶解度/(g/100g水) | ||
| 0℃ | 40℃ | 80℃ | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O | 163 | 215 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:
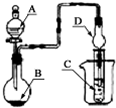
| A、若A为浓硫酸,B为铜,C中盛石蕊试液,则C中溶液先变红后褪色 |
| B、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| C、若A为浓盐酸,B为二氧化锰,C中盛KI-淀粉溶液,则C中溶液变蓝 |
| D、若A为水,B为CaC2固体,C中盛溴水,则C中溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2、KSCN、NaCl、K2SO4(FeCl3溶液) |
| B、NaNO3、NaHCO3、Na2SO3、Na2SiO3(H2SO4溶液) |
| C、NaBr、Na2CO3、KI、CaCl2(AgNO3溶液) |
| D、NH4Cl、Mg(NO3)2、CuSO4、AlCl3(KOH溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:
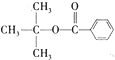 ),注:部分物质省略.
),注:部分物质省略.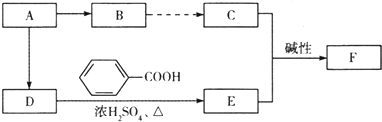

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com