
分析 除杂不能引入新的杂质,则除去FeCl2溶液中的少量FeCl3,选择铁粉;除去FeCl3溶液中的少量FeCl2,选择氯气或氯水等;除去FeCl2溶液中的少量CuCl2,选择过量铁粉.
解答 解:除去FeCl3溶液中的少量FeCl2,选择氯气或氯水等,发生的离子反应为2Fe2++Cl2=2Fe3++2Cl-;
除杂不能引入新的杂质,则除去FeCl2溶液中的少量FeCl3,选择铁粉,发生的离子反应为2Fe3++Fe=3Fe2+;
除去FeCl2溶液中的少量CuCl2,选择过量铁粉,发生的离子反应为Fe+Cu2+=Fe2++Cu,
故答案为:氯气或氯水;2Fe2++Cl2=2Fe3++2Cl-;铁粉;2Fe3++Fe=3Fe2+;铁粉;Fe+Cu2+=Fe2++Cu.
点评 本题考查除杂试剂的选择和离子方程式的书写,题目难度不大,注意相关物质的性质,注重基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{A}{C}$L | B. | $\frac{2A}{3C}$ L | C. | $\frac{2(A+B)}{3C}$ L | D. | $\frac{A+B}{C}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合物中铜和铁各0.075 mol | |
| B. | 稀硝酸的物质的量浓度为0.5 mol•L-1 | |
| C. | 第一次剩余4.8g金属为铜和铁 | |
| D. | 再加入上述100mL稀硝酸,又得到标准状况下1.12 L NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭.“亮菌甲素”的结构简式如图,它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:
2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭.“亮菌甲素”的结构简式如图,它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24.2g | B. | 23.8g | C. | 23.2g | D. | 24.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
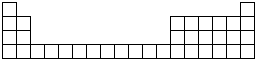 如图为元素周期表中前4周期的表格.甲是一种常见化合物,其化学式为XC13.
如图为元素周期表中前4周期的表格.甲是一种常见化合物,其化学式为XC13.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | NH3、NO2、N2 | B. | NH3、NO、CO2 | C. | HCl、NO2、CO2 | D. | NO、CO2、N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com