
【题目】工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4,下列说法正确的是( )
A. SO2在反应中失去电子B. NaClO3在反应中被氧化
C. H2SO4在反应中得到电子D. 1 mol氧化剂在反应中失去1mol电子
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于某些离子或物质的检验所用试剂或方法不正确的是
A. 某溶液中加入盐酸产生气体,则其中一定含有CO32-
B. 用焰色反应检验钠元素的存在
C. 用氢氧化钠溶液和湿润的红色石蕊试纸检验NH4+
D. 用盐酸和氯化钡溶液检验 SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X(g)+Y(g)2Z(g);正反应放热.从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2→t3的曲线变化是由哪种条件引起的( ) 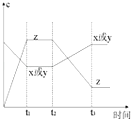
A.增大X或Y的浓度
B.增大压强
C.增大Z的浓度
D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热. 

(1)下列说法不正确的是
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1L 1molL﹣1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3 , 则△H1、△H2、△H3的大小关系为
(4)若将V1mL1.0molL﹣1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列离子方程式对应的一个化学方程式:
(1)2H+ + CO32— = H2O + CO2↑ (2) 2OH-+ Cu2+ = Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 用惰性电极电解等物质的量浓度的FeBr2和CuCl2混合溶液时最初发生:Cu2+ + 2Br - ![]() Cu +Br2
Cu +Br2
B. 碳酸氢钠的水解反应:HCO![]() +H2O
+H2O![]() CO32- + H3O+
CO32- + H3O+
C. 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3 - = BaCO3↓+NH3·H2O+H2O
D. 在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2Fe2O4:3ClO- +2Fe(OH)3 = 2Fe2O42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( ) 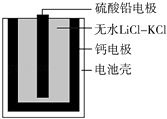
A.正极反应式:Ca+2Cl﹣﹣2e﹣═CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知98%的浓硫酸的物质的量浓度为18.4mol/L,则49%的硫酸的物质的量浓度 ( )
A. 等于9.2 mo1/L B. 小于 9.2 mo1/L
C. 大于 9.2 mo1/L D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com