
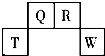
 ¶ĢÖÜĘŚŌŖĖŲ T”¢Q”¢R”¢W ŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆČēĶ¼ĖłŹ¾£¬ĘäÖŠ T Ėł“¦µÄÖÜĘŚŠņŹżÓėÖ÷×å ×åŠņŹżĻąµČ£®ĖüĆĒµÄ×īøß¼ŪŃõ»ÆĪļĖ®»ÆĪļŅĄ“ĪĪŖ¼×”¢ŅŅ”¢±ū”¢¶”£®ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ£Ø””””£©
¶ĢÖÜĘŚŌŖĖŲ T”¢Q”¢R”¢W ŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆČēĶ¼ĖłŹ¾£¬ĘäÖŠ T Ėł“¦µÄÖÜĘŚŠņŹżÓėÖ÷×å ×åŠņŹżĻąµČ£®ĖüĆĒµÄ×īøß¼ŪŃõ»ÆĪļĖ®»ÆĪļŅĄ“ĪĪŖ¼×”¢ŅŅ”¢±ū”¢¶”£®ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ¼×”¢ŅŅ”¢±ū”¢¶”ŹÜČČ¾łŅ×·Ö½ā | |
| B£® | ³£ĪĀĻĀ¶”µÄÅØČÜŅŗæÉÓĆ T µ„ÖŹĖłÖʵÄČŻĘ÷Ą“Ź¢×° | |
| C£® | ¶”µÄÅØČÜŅŗÓė Q µÄµ„ÖŹ¼ÓČČ·¢Éś·“Ó¦£¬æÉÉś³ÉĢå»ż±ČĪŖ 1£ŗ2 µÄĮ½ÖÖĘųĢå | |
| D£® | R µÄŃõ»ÆĪļŌŚæÕĘųÖŠÓėĘäĖüĪļÖŹ×÷ÓĆæÉŠĪ³É¹ā»ÆѧŃĢĪķ |
·ÖĪö ÓɶĢÖÜĘŚŌŖĖŲQ”¢R”¢T”¢WŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆ£¬æÉÖŖQ”¢R“¦ÓŚµŚ¶žÖÜĘŚ£¬T”¢W“¦ÓŚµŚČżÖÜĘŚ£¬TĖł“¦µÄÖÜĘŚŠņŹżÓėÖ÷×åŠņŹżĻąµČ£¬ŌņTĪŖAl£¬æÉĶĘÖŖQĪŖCŌŖĖŲ”¢RĪŖNŌŖĖŲ”¢WĪŖSŌŖĖŲ£®
A”¢H2SO4ŹĒĒæĖį£¬ŗÜĪČ¶Ø£¬ŹÜČČ²»Ņ×·Ö½ā£»
B”¢³£ĪĀĻĀ£¬ĀĮŌŚÅØĮņĖįÖŠ»į¶Ū»Æ£»
C”¢øł¾ŻÅØĮņĖįÓėĢ¼µ„ÖŹµÄ·“Ó¦Ą“·ÖĪö£»
D”¢¹ā»ÆѧŃĢĪķŹĒÓɵŖµÄŃõ»ÆĪļµ¼ÖĀµÄ£®
½ā“š ½ā£ŗÓɶĢÖÜĘŚŌŖĖŲQ”¢R”¢T”¢WŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆ£¬æÉÖŖQ”¢R“¦ÓŚµŚ¶žÖÜĘŚ£¬T”¢W“¦ÓŚµŚČżÖÜĘŚ£¬TĖł“¦µÄÖÜĘŚŠņŹżÓėÖ÷×åŠņŹżĻąµČ£¬ŌņTĪŖAl£¬æÉĶĘÖŖQĪŖCŌŖĖŲ”¢RĪŖNŌŖĖŲ”¢WĪŖSŌŖĖŲ£¬¹Ź¼×ĪŖAl£ØOH£©3£¬ŅŅĪŖH2CO3£¬±ūĪŖHNO3£¬¶”ĪŖH2SO4£®
A”¢Al£ØOH£©3”¢HNO3ŗĶH2CO3ŹÜČČŅ×·Ö½ā£¬H2SO4ŹĒĒæĖį£¬ŗÜĪČ¶Ø£¬ŹÜČČ²»Ņ×·Ö½ā£¬¹ŹA“ķĪó£»
B”¢³£ĪĀĻĀ£¬ĀĮŌŚÅØĮņĖįÖŠ»į¶Ū»Æ£¬¹Ź³£ĪĀĻĀ¶”µÄÅØČÜŅŗæÉÓĆTµ„ÖŹĖłÖʵÄČŻĘ÷Ą“Ź¢×°£¬¹ŹBÕżČ·£»
C”¢ÅØĮņĖįÓėĢ¼µ„ÖŹµÄ·“Ó¦£ŗ2H2SO4£ØÅØ£©+C$\frac{\underline{\;¼ÓČČ\;}}{\;}$2SO2”ü+CO2”ü+2H2O£¬¹ŹæÉÉś³ÉĢå»ż±ČĪŖ1£ŗ2µÄĮ½ÖÖĘųĢ壬¹ŹCÕżČ·£»
D”¢¹ā»ÆѧŃĢĪķŹĒÓɵŖµÄŃõ»ÆĪļµ¼ÖĀµÄ£¬¹ŹŹĒRµÄŃõ»ÆĪļµ¼ÖĀµÄ£¬¹ŹDÕżČ·£®
¹ŹŃ”A£®
µćĘĄ ±¾Ģāæ¼²é½į¹¹ŠŌÖŹĪ»ÖĆ¹ŲĻµÓ¦ÓĆ£¬ÄŃ¶Č²»“ó£¬Ó¦×¢ŅāŌŖĖŲµÄĶʵ¼ŗĶĘä¶ŌÓ¦×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļµÄŠŌÖŹ£¬²ąÖŲÓŚæ¼²éѧɜ¶Ō»ł“”ÖŖŹ¶µÄ×ŪŗĻÓ¦ÓĆÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā


 £Ø±½°·£¬Ņ×±»Ńõ»Æ£©
£Ø±½°·£¬Ņ×±»Ńõ»Æ£© µÄĆū³ĘĪŖĮŚōĒ»ł±½¼×Ėį£»
µÄĆū³ĘĪŖĮŚōĒ»ł±½¼×Ėį£» £»
£» £»
£» µÄŗĻ³ÉĀ·Ļߣ®£ØĪŽ»śŹŌ¼ĮČĪÓĆ£©
µÄŗĻ³ÉĀ·Ļߣ®£ØĪŽ»śŹŌ¼ĮČĪÓĆ£©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
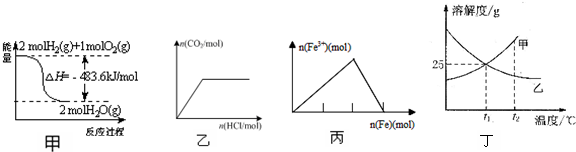
| A£® | ¼×±ķŹ¾H2ÓėO2·¢Éś·“Ó¦¹ż³ĢÖŠµÄÄÜĮæ±ä»Æ£¬ŌņH2µÄČ¼ÉÕČČĪŖ241.8 kJ•mol-1 | |
| B£® | ŅŅ±ķŹ¾ĻņNa2CO3ČÜŅŗÖŠÖšµĪµĪ¼ÓĻ”ŃĪĖį£¬Éś³ÉCO2ÓėĖł¼ÓŃĪĖįĪļÖŹµÄĮæµÄ¹ŲĻµ | |
| C£® | ±ū±ķŹ¾ŌŚĻ”ĻõĖįČÜŅŗÖŠ¼ÓČėĢś·Ū£¬ČÜŅŗÖŠFe3+ÅØ¶ČµÄ±ä»ÆĒśĻß | |
| D£® | ¶”±ķŹ¾t1”ꏱ֏Įæ·ÖŹż¾łĪŖ20%µÄ¼×”¢ŅŅĮ½ÖÖČÜŅŗ£¬ÉżĪĀµ½t2”ꏱ£¬Į½ÖÖČÜŅŗÖŠČÜÖŹµÄÖŹĮæ·ÖŹżČŌČ»ĻąµČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µē½ā¾«Į¶ĶµÄ¹ż³ĢÖŠ£¬Ćæ×ŖŅĘNAøöµē×ÓŹ±£¬Ńō¼«ČܽāĶµÄÖŹĮæĪŖ32g | |
| B£® | 1 mol Na2O2¹ĢĢåÖŠŗ¬Ąė×Ó×ÜŹżĪŖ4NA | |
| C£® | 1molōĒ»łÓė17 g NH3Ėłŗ¬µē×ÓŹżÖ®±ČĪŖ9£ŗ10 | |
| D£® | 1mol Na2CO3¾§ĢåÖŠŗ¬ CO${\;}_{3}^{2-}$Ąė×ÓŹżŠ”ÓŚ1 NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ļņ·ŠĖ®ÖŠµĪ¼Ó±„ŗĶFeCl3ČÜŅŗ£¬ČÜŅŗ³ŹŗģŗÖÉ«£ŗFe3++3H2OØTFe£ØOH£©3”ż+3H+ | |
| B£® | NaClOČÜŅŗÖŠĶØČė¹żĮæSO2£ŗClO-+SO2+H2OØTHClO+HS03- | |
| C£® | ÓĆĶ×÷µē¼«µē½āCuSO4ČÜŅŗ£ŗ2Cu2++2H2O$\frac{\underline{\;µē½ā\;}}{\;}$2Cu+O2”ü+4H+ | |
| D£® | ĻņĆ÷·ÆČÜŅŗÖŠµĪ¼ÓÉŁĮæBa£ØOH£©2£ŗ2Al3++3SO4 2-+3Ba2++6OH-ØT2Al£ØOH£©3”ż+3BaSO4”ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 22 g 2H218OÖŠŗ¬ÓŠµÄÖŹ×ÓŹżĪŖ10NA | |
| B£® | µē½ā58.5 gČŪČŚµÄNaCl£¬ÄܲśÉś11.2 LĀČĘų£Ø±ź×¼×“æö£©”¢23.0 g½šŹōÄĘ | |
| C£® | 1.00 mol NaClÖŠ£¬ĖłÓŠNa+µÄ×īĶā²ćµē×Ó×ÜŹżĪŖ10NA | |
| D£® | 1 mol NaÓė×ćĮæO2·“Ó¦£¬Éś³ÉNa2OŗĶNa2O2µÄ»ģŗĻĪļ£¬ÄĘŹ§Č„NAøöµē×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | ²½Öč¢ńÖŠ¼õÉŁµÄ3 g¹ĢĢåŅ»¶ØŹĒ»ģŗĻĪļ | |
| B£® | ²½Öč¢ņÖŠÖŹĮæ¼õÉŁµÄĪļÖŹŅ»¶ØŹĒCu | |
| C£® | øł¾ŻÉĻŹö²½Öč¢ņæÉŅŌµĆ³öm£ØFe2O3£©£ŗm£ØCu£©=1£ŗ1 | |
| D£® | øł¾Ż²½Öč¢ń”¢¢ņæÉŅŌÅŠ¶Ļ»ģŗĻĪļXµÄ³É·ÖĪŖAl2O3”¢Fe2O3”¢Cu”¢SiO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 ijŠ£»ÆѧŠĖȤŠ”×éµÄĶ¬Ń§¶ŌŅ»ŗ¬ÓŠÉŁĮæNa2SO4µÄNaOHѳʷ֊NaOHµÄŗ¬Įæ½ųŠŠ²ā¶Ø£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
ijŠ£»ÆѧŠĖȤŠ”×éµÄĶ¬Ń§¶ŌŅ»ŗ¬ÓŠÉŁĮæNa2SO4µÄNaOHѳʷ֊NaOHµÄŗ¬Įæ½ųŠŠ²ā¶Ø£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ| V£ØHCl£©/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
| ÖøŹ¾¼Į | ±äÉ«·¶Ī§£ØpH£© | ŃÕÉ« | |
| Ėį | ¼ī | ||
| ¼×»ł³Č | 3.1”«4.4 | ŗģ | »Ę |
| ŹÆČļ | 5.0”«8.0 | ŗģ | Ą¶ |
| ·ÓĢŖ | 8.2”«10.0 | ĪŽ | ŗģ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com