
| A. | 等质量的NaOH和KOH分别与足量的盐酸反应,前者消耗HCl的量比后者少 | |
| B. | 观察钠元素焰色反应的颜色要透过蓝色钴玻璃进行观察 | |
| C. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| D. | 透闪石的化学成分为Ca2Mg5Si8O22(OH)2 写成氧化物的形式为2CaO•5MgO•8SiO2•H2O |
分析 A.KOH、NaOH的摩尔质量不同,等质量时NaOH的物质的量多;
B.焰色反应为元素的性质,观察K的焰色反应需要透过蓝色的钴玻璃;
C.水晶饰物的成分为二氧化硅;
D.用氧化物形式表示硅酸盐的组成时,先写金属氧化物(按照金属活泼性),再写二氧化硅,后写水,遵循原子守恒.
解答 解:A.KOH、NaOH的摩尔质量不同,等质量时NaOH的物质的量多,则等质量的NaOH和KOH分别与足量的盐酸反应,前者消耗HCl的量比后者多,故A错误;
B.焰色反应为元素的性质,观察K的焰色反应需要透过蓝色的钴玻璃,则可直接观察钠的焰色反应,故B错误;
C.水晶饰物的成分为二氧化硅,而水泥、玻璃都是硅酸盐制品,故C错误;
D.用氧化物形式表示硅酸盐的组成时,先写金属氧化物(按照金属活泼性),再写二氧化硅,后写水,遵循原子守恒,则Ca2Mg5Si8O22(OH)2 写成氧化物的形式为2CaO•5MgO•8SiO2•H2O,故D正确;
故选D.
点评 本题考查较综合,为高频考点,把握化学反应的计算、焰色反应、硅酸盐及物质组成为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | 反应的平衡常数:③>①>② | |
| B. | 达到平衡时氨气的体积分数:①>③ | |
| C. | 放出的热量(kJ):a<b<92.4 | |
| D. | 反应得到1mol NH3(l),放出热量46.2kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

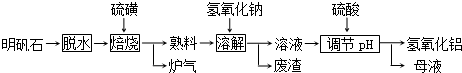
 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$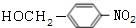 +NaCl.
+NaCl.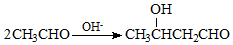 .
.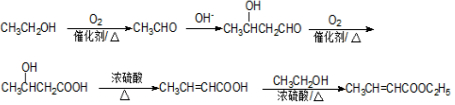 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
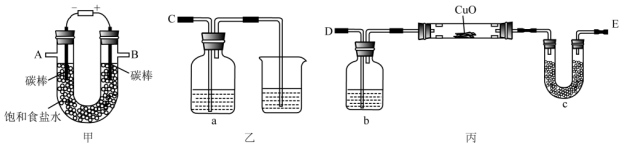
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
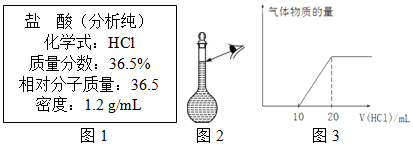
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL0.4mol/L的盐酸 | B. | 10mL0.3mol/LMgCl2溶液 | ||
| C. | 10mL0.5mol/LNaCl溶液 | D. | 10mL0.1mol/LAlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com