
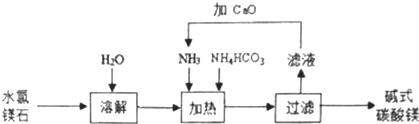
分析 以水氯镁石(主要成分为MgCl2•6H2O)为原料生产碱式碳酸镁[Mgx(CO3)y(OH)z•wH2O],水溶解后得到氯化镁溶液,向氯化镁溶液中加入氨气、碳酸氢铵,加热,反应能生成碱式碳酸镁和氯化铵,过滤后滤液的主要溶质是氯化铵,铵根离子能和显碱性的物质反应生成氨气,氧化钙能和水反应生成显碱性的氢氧化钙溶液,可以用氧化钙和水反应生成的氢氧化钙,结合铵根离子生成氨气循环使用,进行解答;
(1)分析可知溶液中滤液中溶质的主要成分为氯化铵,向滤液中加入CaO的目的是和氨盐反应生成氨气循环使用;
(2)上述流程中,检验“过滤”后碱式碳酸镁已洗涤干净是检验最后一次洗涤液中是否含有氯离子,可以加入硝酸银溶液观察是否生成白色沉淀;
(3)n(Mg2+)=n(MgO)=$\frac{2.00g}{40g/mol}$=0.05 mol,n(CO32-)=n(CO2)=$\frac{0.896L}{22.4L/mol}$=0.04 mol,
根据化合物中电荷守恒计算:n(OH-)=0.05 mol×2-0.04 mol×2=0.02mol,
m (H2O)=4.66g-2.00g-0.04 mol×44 g/mol=0.9 g,
n(H2O)=$\frac{0.9g}{8mol}$=0.05 mol,
结晶水的物质的量:n(H2O)═0.05 mol-$\frac{0.02mol}{2}$=0.04 mol,
据此计算x:y:z:w之比得到化学式.
解答 解:以水氯镁石(主要成分为MgCl2•6H2O)为原料生产碱式碳酸镁[Mgx(CO3)y(OH)z•wH2O],水溶解后得到氯化镁溶液,向氯化镁溶液中加入氨气、碳酸氢铵,加热,反应能生成碱式碳酸镁和氯化铵,过滤后滤液的主要溶质是氯化铵,铵根离子能和显碱性的物质反应生成氨气,氧化钙能和水反应生成显碱性的氢氧化钙溶液,可以用氧化钙和水反应生成的氢氧化钙,结合铵根离子生成氨气循环使用,
(1)上述流程中,滤液中溶质的主要成分是NH4Cl,向滤液中加入CaO的目的是与滤液中NH4Cl 反应产生NH3循环使用,
故答案为:NH4Cl,与滤液中NH4Cl 反应产生NH3循环使用;
(2)检验最后一次洗涤液中是否含有氯离子,可以加入硝酸银溶液观察是否生成白色沉淀,实验设计为:取最后一次洗涤液适量于试管中,滴加AgNO3溶液,若无白色浑浊出现,则证明已洗涤干净,
故答案为:取最后一次洗涤液适量于试管中,滴加AgNO3溶液,若无白色浑浊出现,则证明已洗涤干净;
(3)n(Mg2+)=n(MgO)=$\frac{2.00g}{40g/mol}$=0.05 mol,n(CO32-)=n(CO2)=$\frac{0.896L}{22.4L/mol}$=0.04 mol,
根据化合物中元素化合价代数和为零 n(OH-)=0.05 mol×2-0.04 mol×2=0.02mol,
m (H2O)=4.66g-2.00g-0.04 mol×44 g/mol=0.9 g,
n(H2O)=$\frac{0.9g}{8mol}$=0.05 mol,
结晶水的物质的量:n(H2O)═0.05 mol-$\frac{0.02mol}{2}$=0.04 mol,
则得x:y:z:w=0.05:0.04:0.02:0.04=5:4:2:4
碱式碳酸镁的化学式为:Mg5(CO3)4(OH)2•4H2O,
故答案为:n(Mg2+)=n(MgO)=$\frac{2.00g}{40g/mol}$=0.05 mol,n(CO32-)=n(CO2)=$\frac{0.896L}{22.4L/mol}$=0.04 mol,
根据化合物中元素化合价代数和为零 n(OH-)=0.05 mol×2-0.04 mol×2=0.02mol,
m (H2O)=4.66g-2.00g-0.04 mol×44 g/mol=0.9 g,
n(H2O)=$\frac{0.9g}{18g/mol}$=0.05 mol,
结晶水的物质的量:n(H2O)═0.05 mol-$\frac{0.02mol}{2}$=0.04 mol,
则得x:y:z:w=0.05:0.04:0.02:0.04=5:4:2:4
碱式碳酸镁的化学式为:Mg5(CO3)4(OH)2•4H2O.
点评 本题考查了盐的性质中实验方法和过程的探究,根据物质的化学性质,要认真分析,不仅要把握实验设计的每一个步骤中的实验目的,还要加强记忆除去常用离子的方法,从而突破难点.有关的计算要准确,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 电解质溶液 | 阳极 | 阴极 | 加入的物质 | |
| A | NaCl溶液 | 碳 | 铁 | 盐酸 |
| B | 稀硫酸 | 铜 | 碳 | 水 |
| C | 硫酸铜溶液 | 铜 | 碳 | 硫酸铜 |
| D | NaOH溶液 | 碳 | 铁 | 水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量8.70g食盐 | |
| B. | 用广泛pH试纸测定氯水的pH值为3.5 | |
| C. | 在蒸发皿中灼烧氢氧化铁获得铁红 | |
| D. | 用加热的方法分离氯化钠和氯化铵的固体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18H2O含有的氢原子数目为NA | |
| B. | 1molFe与足量盐酸反应失去的电子数为3NA | |
| C. | 标准状况下,22.4L等物质的量的CO2和O2混合气体中含有氧原子数为2NA | |
| D. | 2mol•L-1NaCl溶液中含有Na+个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数目相等的三种气体,质量最大的是Z | |
| B. | 相同条件下,同质量的三种气体,气体密度最小的是X | |
| C. | 若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1mol | |
| D. | 同温下,体积相同的两容器分别充2gY气体和1gZ气体,则其压强比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙醚互为同分异构体 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应 | |
| D. | 在酸性条件下,蔗糖水解的化学方程式为 C12H22O11+H2O→2C6H12O6(葡萄糖) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com