
| A、1:3 | B、1:4 |
| C、2:3 | D、3:4 |
| 24 |
| 2 |
| x |
| 2 |
| 54 |
| 6 |
| y |
| 2 |


科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| A、0.1 mol?L-1HA溶液与0.05 mol?L-1NaOH溶液等体积混合后所得溶液中2c(H+)+c(HA)=c(A-)+c(OH-) |
| B、浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
| C、0.1 mol?L-1HA溶液与0.05 mol?L-1NaOH溶液等体积混合后所得溶液中c(A-)+c(HA)=c(Na+) |
| D、该溶液中由水电离出的c(H+)=1×10-11mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、任何化学反应都可以设计成电解池反应 |
| B、电镀铜和电解精炼铜时,电解质溶液中的c( Cu2+)均保持不变 |
| C、电解冶炼镁、铝通常电解MgCl2 和Al2O3,也可电解MgO和AlCl3 |
| D、若把Cu+H2SO4═CuSO4+H2↑ 设计成电解池,应用Cu作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
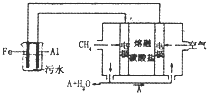 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间通过电解生成Fe(OH)3沉淀,Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用,阴极产生的气泡把把污水中悬浮物带到水面而形成浮液层,刮去(或撇掉)浮渣层即起到了浮选净化作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间通过电解生成Fe(OH)3沉淀,Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用,阴极产生的气泡把把污水中悬浮物带到水面而形成浮液层,刮去(或撇掉)浮渣层即起到了浮选净化作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后的固体混合物中不含碳 |
| B、反应后的固体混合物总质量为13.6 g |
| C、反应后的固体混合物中氧化物的物质的量为0.05 mol |
| D、反应后转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2g | B、5.6g |
| C、2.8g | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:2 |
| C、1:4 | D、2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com