
【题目】A、B、C、D、E五种短周期元素的原子序数依次增大;A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素形成的某种单质是自然界中最硬的物质;A与D可以形成原子个数比分别为1:1和2 : 1的两种液态化合物;E的气态氧化物能使品红溶液褪色,加热品红恢复红色。请回答:
(1)E的原子结构示意图为_______________。
(2)可以验证B与E两元素非金属性强弱的方法是_________(填写字母序号)。
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的最高价氧化物对应水化物的酸性
C.比较只有这两种元素所形成的简单化合物中元素的化合价
(3)写出由A、C两种元素组成的原子个数比为2:1的化合物的电子式_________________。
(4)写出由A、B、C、D四种元素组成的离子个数比为1:1的化合物的化学式_______________。
(5) A分别与B、C、D形成的最简单化合物的稳定性由强到弱的顺序为______________(用化学式表示)。
(6)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程简述如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3混合溶液中,生成两种碱,写出该反应的总离子方程式______________________________________________。
②上述反应得到的两种碱在一定条件下继续作用得到Fe3O4,写出该反应的化学方程式______________________________________________。
(7)将8.4gFe加入某浓度的C的最高价氧化物对应水化物的溶液中,充分反应后,Fe无剩余(且滴加KSCN溶液无明显现象),生成标况下的CD和CD2两种气体共4.032L,其中含 CD________mol。
【答案】 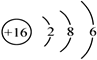 B 、C
B 、C ![]() NH4HCO3 (CH3COONH4或HCOONH4等) H2O > NH3 > CH4 Fe2++2Fe3++8NH3+8H2O=Fe(OH)2↓+2Fe(OH)3↓+8NH4+ Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O 0.06
NH4HCO3 (CH3COONH4或HCOONH4等) H2O > NH3 > CH4 Fe2++2Fe3++8NH3+8H2O=Fe(OH)2↓+2Fe(OH)3↓+8NH4+ Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O 0.06
【解析】A、B、C、D、E五种短周期元素的原子序数依次增大;A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素形成的某种单质是自然界中最硬的物质,B是C;A与D可以形成原子个数比分别为1:1和2:1的两种液态化合物,所以A是H,D是O,则C是N;E的气态氧化物能使品红溶液褪色,加热品红恢复红色,E是S。则
(1)S的原子结构示意图为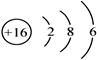 。(2)A.非金属性强弱与氢化物的沸点没有关系,A错误;B.非金属性越强,最高价含氧酸的酸性越强,则比较这两种元素的最高价氧化物对应水化物的酸性可以比较非金属性强弱,B正确;C.非金属性越强,越容易吸引共用电子对,因此比较只有这两种元素所形成的简单化合物中元素的化合价可以比较非金属性强弱,C正确,答案选BC;(3)由A、C两种元素组成的原子个数比为2:1的化合物是N2H4,属于含有共价键的共价化合物,电子式为
。(2)A.非金属性强弱与氢化物的沸点没有关系,A错误;B.非金属性越强,最高价含氧酸的酸性越强,则比较这两种元素的最高价氧化物对应水化物的酸性可以比较非金属性强弱,B正确;C.非金属性越强,越容易吸引共用电子对,因此比较只有这两种元素所形成的简单化合物中元素的化合价可以比较非金属性强弱,C正确,答案选BC;(3)由A、C两种元素组成的原子个数比为2:1的化合物是N2H4,属于含有共价键的共价化合物,电子式为![]() 。(4)由H、C、N、O四种元素组成的离子个数比为1:1的化合物可以是碳酸氢铵,化学式为NH4HCO3。(5)非金属性越强,氢化物越稳定,非金属性是O>N>C,则A分别与B、C、D形成的最简单化合物的稳定性由强到弱的顺序为H2O>NH3 >CH4。(6)①将化合物NH3通入等物质的量的FeSO4、Fe2(SO4)3混合溶液中,生成两种碱,应该是氢氧化铁和氢氧化亚铁,根据原子守恒可知该反应的总离子方程式为Fe2++2Fe3++8NH3+8H2O=Fe(OH)2↓+2Fe(OH)3↓+8NH4+。②上述反应得到的两种碱在一定条件下继续作用得到Fe3O4,根据原子守恒可知该反应的化学方程式为Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O。(7)8.4g铁的物质的量是8.4g÷56g/mol=0.15mol,充分反应后,Fe无剩余(且滴加KSCN溶液无明显现象),这说明生成物是亚铁离子。混合气体的物质的量是4.032L÷22.4L/mol=0.18mol,设NO和NO2的物质的量分别是xmol、ymol,则根据原子守恒和电子得失守恒可知x+y=0.18、3x+y=0.15×2,解得x=0.06,y=0.12。
。(4)由H、C、N、O四种元素组成的离子个数比为1:1的化合物可以是碳酸氢铵,化学式为NH4HCO3。(5)非金属性越强,氢化物越稳定,非金属性是O>N>C,则A分别与B、C、D形成的最简单化合物的稳定性由强到弱的顺序为H2O>NH3 >CH4。(6)①将化合物NH3通入等物质的量的FeSO4、Fe2(SO4)3混合溶液中,生成两种碱,应该是氢氧化铁和氢氧化亚铁,根据原子守恒可知该反应的总离子方程式为Fe2++2Fe3++8NH3+8H2O=Fe(OH)2↓+2Fe(OH)3↓+8NH4+。②上述反应得到的两种碱在一定条件下继续作用得到Fe3O4,根据原子守恒可知该反应的化学方程式为Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O。(7)8.4g铁的物质的量是8.4g÷56g/mol=0.15mol,充分反应后,Fe无剩余(且滴加KSCN溶液无明显现象),这说明生成物是亚铁离子。混合气体的物质的量是4.032L÷22.4L/mol=0.18mol,设NO和NO2的物质的量分别是xmol、ymol,则根据原子守恒和电子得失守恒可知x+y=0.18、3x+y=0.15×2,解得x=0.06,y=0.12。


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】漂白粉在空气中放置易失效的主要原因是( )
A. Ca(ClO)2不稳定,易分解 B. Ca(ClO)2易吸收水分而潮解
C. Ca(ClO)2跟空气中的水和CO2反应 D. Ca(ClO)2跟空气中的CO2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn +2K2FeO4+8H2O =3Zn(OH)2 +2Fe(OH)3 +4KOH。下列叙述正确的是( )
A.放电时,正极区溶液的pH减小
B.放电时,负极反应式为3Zn-6e-+6OH-=3Zn(OH)2
C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原
D.充电时,电池的锌电极接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有硫酸根离子、碳酸根离子等。为了检验其中是否含有硫酸根离子,除氯化钡溶液外,还需要的溶液是( )
A. 硫酸溶液 B. 盐酸溶液 C. 氢氧化钠溶液 D. 硝酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为C(s)+H2O(g)═CO(g)+H2(g).C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1 ,
H2(g)+ ![]() O2(g)═H2O(g)△H2=﹣242.0kJmol﹣1 ,
O2(g)═H2O(g)△H2=﹣242.0kJmol﹣1 ,
CO(g)+ ![]() O2(g)═CO2(g)△H3=﹣283.0kJmol﹣1 .
O2(g)═CO2(g)△H3=﹣283.0kJmol﹣1 .
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式: .
(2)比较反应热数据可知,1mol CO(g)和1mol H2(g)完全燃烧放出的热量之和,比1mol C(s)完全燃烧放出的热量(填“多”或“少”).
(3)甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量.”
乙同学根据盖斯定律作出了下列循环图: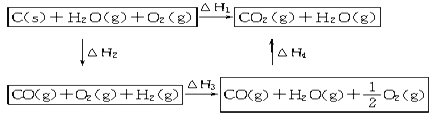
请你写出△H1、△H2、△H3、△H4之间存在的关系式 .
(4)乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同.”请分析:甲、乙两同学观点正确的是(填“甲”或“乙”)同学,另一同学出现错误观点的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下式表示一种有机物的结构,关于它的性质叙述不正确的是

A. 分子式为C14H10O3
B. 分子中的碳、氧原子可能都处于同一平面
C. 1mol该化合物最多可以与含8molNaOH的溶液反应
D. 它在稀硫酸条件下水解生成的有机产物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B. 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定
C. 已知2C(s)+2O2(g)═2CO2(g)△H12C(s)+O2(g)═2CO(g)△H2,则△H1>△H2
D. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com