
分析 原电池形成条件是活泼性不同的两个电极,电解质溶液,闭合回路,自发进行的氧化还原反应,原电池中,得电子发生还原反应的电极是正极,失电子发生氧化反应的电极是正极,电子流向从负极盐导线流向正极,根据得失电子判断电极名称.
解答 解:由铜、锌和稀硫酸组成的原电池中,锌做负极失电子发生氧化反应,电极反应为Zn-2e-=Zn2+;铜做正极,溶液中氢离子得到电子生成氢气,发生还原反应,电极反应为2H++2e-=H2↑,铜极表面产生气泡,
故答案为:负;氧化;Zn-2e-=Zn2+;正,2H++2e-=H2↑.
点评 本题考查原电池的正负极的判断及电极反应式,注意根据氧化还原反应得失电子判断原电池的正负极,题目较简单.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
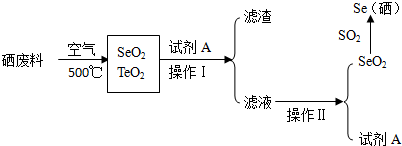
 | 沸点/℃ | 溶解性 |
| SeO2 | 684 | 易溶于水和乙醇 |
| TeO2 | 1260 | 微溶于水,不溶于乙醇 |
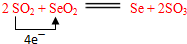 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K层多 | B. | L层多 | C. | 相等 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Li<Na<K | B. | 稳定性:PH3>H2S>HCl | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3<Mg(OH)2<KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ①②⑤ | C. | ②⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2、HCl | B. | Ba(NO3)2、HNO3 | C. | Ba(NO3)2、HCl | D. | BaCl2、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
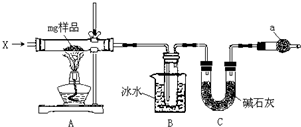 为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下:
为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com