
【题目】1-丁炔的结构简式是____________,它与过量溴加成后产物的名称是_________;有机物A的分子式与1-丁炔相同,而且属于同一类别,A与过量溴加成后产物的名称是_______;与1-丁炔属于同系物的且所含碳原子数最少的有机物是______,它能发生_______反应填反应类别制成导电塑料![]() ,这是21世纪具有广阔前景的合成材料。
,这是21世纪具有广阔前景的合成材料。
【答案】CH≡C-CH2-CH3 1,1,2,2-四溴丁烷 2,2,3,3-四溴丁烷 CH≡CH 加聚
【解析】
1-丁炔为CH≡C-CH2-CH3,含碳碳三键,能够与溴以1∶2完全加成;有机物A的分子式与1-丁炔相同,且属于同一类别,则A为CH3C≡CCH3;与1-丁炔互为同系物,且所含碳原子数最少的有机物为乙炔,可发生加聚反应生成聚乙炔,据此分析解答。
1-丁炔的结构简式为CH≡C-CH2-CH3,1-丁炔与过量溴1∶2发生加成反应生成CHBr2CBr2CH2CH3,其名称为1,1,2,2-四溴丁烷;机物A的分子式与1-丁炔相同,且属于同一类别,则A为CH3C≡CCH3,含碳碳三键,与溴以1∶2加成,与过量溴加成的产物的名称是2,2,3,3-四溴丁烷;与1-丁炔属于同系物的且所含碳原子数最少的有机物是乙炔,结构简式为CH≡CH;乙炔能发生加聚反应生成聚乙炔,故答案为:CH≡C-CH2-CH3;1,1,2,2-四溴丁烷;2,2,3,3-四溴丁烷;CH≡CH;加聚。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率与平衡常数均增大
B.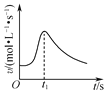 如图是镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
如图是镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
C.反应2HI(g)H2(g)+I2(g),达到平衡后,缩小容器容积可使体系颜色变深。该现象不能用勒夏特列原理解释
D.若反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)在常温下能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Fe2+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+B.Al3+C.Ca2+D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O72-转移4.8 mol e-,该反应离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 2Na + 2H2O = 2NaOH + H2↑,该反应中相关物质的化学用语中正确的是
A.H2 的结构式:H-H
B.中子数为 12 的钠原子:![]()
C.H2O 的电子式:![]()
D.Na+的结构示意图:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置的说法正确的是
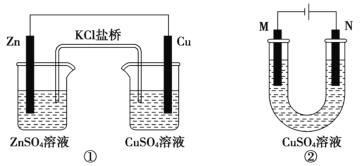
A.装置①将电能转变为化学能
B.装置①中盐桥内的 K+移向 CuSO4 溶液
C.若装置②用于铁棒镀铜,则 N 极为铁棒
D.若装置②用于电解精炼铜,溶液中的 Cu2+浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓硫酸和乙醇混合加热制取乙烯,下列说法正确的个数是( )

①浓硫酸只作催化剂
②在反应容器中放入几片碎瓷片防止混合液暴沸
③反应温度缓慢上升至 170℃
④用排水法或向下排气法收集乙烯
⑤圆底烧瓶中装的是 4mL 乙醇和 12mL 3mol/L H2SO4混合液
⑥温度计应插入反应溶液液面下,以便控制温度
⑦反应完毕后先熄灭酒精灯,再从水中取出导管
⑧该反应类型属于取代反应
⑨若 a 口出来的气体使酸性 KMnO4溶液褪色,说明有乙烯生成
A.1B.2C.3D.4 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃(PMMA)是一种具有优良的光学性、耐腐蚀性的高分子聚合物,其合成路线之一如图所示:

请回答下列问题:
(1)写出检验A中官能团所需试剂及现象__、__。
(2)用系统命名法给B命名__。
(3)写出C与足量的NaOH乙醇溶液,在加热条件下反应的化学方程式__。
(4)写出E生成PMMA反应的化学方程式__。
(5)下列说法正确的是__。
a.B的核磁共振氢谱有3组峰,峰面积比为6∶1∶1
b.B→C的反应类型为取代反应
c.D中存在顺反异构
d.1molPMMA发生水解反应时消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应2HI(g)=H2(g) + I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___kJ。
(2)已知某密闭容器中存在下列平衡:CO(g)+H2O(g) ![]() CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。

①该反应△H__________ 0(填“>”或“<”)
②若T1、T2时的平衡常数分别为K1、K2,则K1_______K2(填“>”、“<”或“=”)。
③T3时在某刚性容器中按1:2投入CO(g)和H2O(g),达到平衡后测得CO的转化率为75%,则T3时平衡常数K3=____________。
(3)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应: 2MoS2(s)+7O2(g) ![]() 2MoO3(s)+4SO2(g) ΔH。
2MoO3(s)+4SO2(g) ΔH。
测得氧气的平衡转化率与起始压强、温度的关系如图所示:

①p1、p2、p3的大小:_________。
②若初始时通入7.0 mol O2,p2为7.0 kPa,则A点平衡常数Kp=________(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(4)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_______助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是_____;
②下列说法正确的是______;
a 第ⅰ步所反应为:CO2+H2![]() CO+H2O
CO+H2O
b 第ⅰ步反应的活化能低于第ⅱ步
c 催化剂助剂主要在低聚反应、异构化反应环节起作用
d Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e 添加不同助剂后,反应的平衡常数各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银精矿(其化学成分有:Ag、Zn、Cu、Pb、S及SiO2等)中提取银、铜和铅,工艺流程如图所示。

(1)步骤①当盐酸的浓度和KClO3的量一定时,写出两点可提高“浸取”速率的措施______;从Cu和Pb混合物中提取Cu的试剂为______(填名称)。
(2)步骤③反应的化学方程式为______。
(3)步骤④分离出的滤渣中主要含有两种杂质,为了回收滤渣中的非金属单质,某实验小组向滤渣中加入试剂______(填化学式),充分溶解后过滤,然后将滤液进行______(填操作名称),得到该固体非金属单质。
(4)步骤⑤反应中氧化剂和还原剂的物质的量之比为______。
(5)排放后的废水中含有NO3-,任意排放会造成水体污染,科技人员在碱性条件下用Al粉将NO3-还原成无污染气体排放,该方法的缺点是处理后的水中生成了AlO2-,依然对人类健康有害。该反应的离子方程式为:______。25℃时,欲将上述处理过的水中的c(AlO2-)降到1.0×10-7mol/L,此时水中c(Al3+)=______molL-1.(已知,25℃,Ksp(Al(OH)3]=1.3×10-33,Al(OH)3(s)H++AlO2-+H2O,Ka=1.0×10-13)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com