
| A. | 制备干燥的NH3:加热浓氨水,将生成的气体通过盛有浓硫酸的洗气瓶 | |
| B. | 提纯含有少量HCl的CO2:将混合气体依次通过盛有饱和碳酸钠溶液、浓硫酸的洗气瓶 | |
| C. | 检验食盐中是否含有碘酸钾:取少量的食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象 | |
| D. | 探究温度对化学平衡移动的影响:将盛有NO2和N2O4混合气体的烧瓶,先后置于冷水和热水中,观察烧瓶中气体颜色的变化 |
分析 A.氨气能与硫酸反应生成硫酸铵;
B.二者均与碳酸钠溶液反应;
C.碘单质遇淀粉试液变蓝色;
D.温度不同,二氧化氮和四氧化二氮之间的平衡改变而向吸热或者方向移动.
解答 解:A.氨气能与硫酸反应生成硫酸铵,应用碱石灰干燥,故A错误;
B.二者均与碳酸钠溶液反应,不能除杂,应加饱和碳酸氢钠溶液、洗气来除杂,故B错误;
C.碘单质遇淀粉试液变蓝色,碘酸钾中不含碘单质,所以与淀粉实验不反应变色,故C错误;
D.温度不同,导致二氧化氮和四氧化二氮之间的平衡改变而向吸热或者方向移动,能达到目的,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物的分离提纯、除杂及检验等,侧重物质性质及实验技能的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | K+、CO32-、Cl-、NO3- | B. | MnO4-、K+、OH-、SO42- | ||
| C. | Cl-、SO42-、Cu2+、Ba2+ | D. | Mg2+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
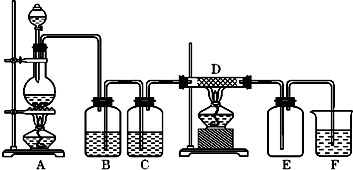
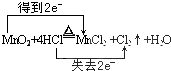 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
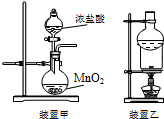
| A. | 用装置甲可以制备氯气 | |
| B. | 用装置乙分离泥沙中的碘单质 | |
| C. | 向碘酒中加入CCl4,静置后分液,可以分离碘酒中的碘 | |
| D. | 用玻璃棒蘸取NaClO溶液点在pH试纸上,测定溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离方程式:Na2SO4═Na2++SO42- | B. | 氯化钠的电子式: | ||
| C. | 14C的原子结构示意图: | D. | CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com