
����Ŀ����ľ�ҵ���Ч�ɷ���K2CO3��������������Na����Cl����SO42���ʹ���������ˮ�Ĺ��塣Ϊ�ⶨ����K2CO3�ĺ������������ʵ�飺

���������գ�
��1��ϴ��������Ŀ����_____________________________________��
��2������100 mL��ľ�ҽ���Һ����Ҫʹ�õIJ����������ձ�������������ͷ�ιܡ�______��
��3��ȡ��10.00 mL����Һ���еζ����յ�ʱ��Һ��______ɫ���______ɫ��������ƽ��ʵ���������������ƽ��ֵΪ25.00 mL�������Ʒ��̼��ص���������Ϊ______����ȷ��С�����3λ����
��4����û���ñ�Һ��ϴ�ζ��ܣ���ʵ������___������ƫ��������ƫС��������Ӱ��������
��5��������ͼװ�ã�ͨ����Ӧǰ���������ĸı䣬ȷ��CO2�����������Ҳ���Բⶨ��Ʒ��̼��صĺ�����ʵ��ʱ������Ӧ�����ӷ���ʽΪ_______________________���жϷ�Ӧ��ȫ��������_____________________����Ը�ʵ�鷽������ȱ��������ۡ�________________

���𰸡� ����������������̼���ϴ��������һ�����Ƴɴ���Һ������������� 100 mL����ƿ ��ɫ ��ɫ 0.115 ƫ�� CO32����2H�� �� CO2����H2O ������ƽ�Ķ������ٷ����仯 �ŵ㣺������㣻ȱ�㣺�ݳ��Ķ�����̼�к���ˮ�������Ȼ��⣬����ɽϴ�ʵ�����
����������1��ϴ��������Ŀ���ǽ���������������̼���ϴ��������һ�����Ƴɴ���Һ��������������2������������������֪����ȱ��100mL����ƿ����3��ȡ��10.00 mL����Һ���еζ����յ�ʱ��Һ�ɻ�ɫ��ɳ�ɫ��������ƽ��ʵ���������������ƽ��ֵΪ25.00 mL�������Ʒ��̼��ص���������Ϊ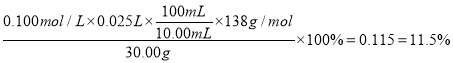 ����4����û���ñ�Һ��ϴ�ζ��ܣ���ҺŨ�ȱ�ϡ���ζ�ʱ���ı�Һƫ�࣬��ʵ������ƫ������5��������ͼװ�ã�ͨ����Ӧǰ���������ĸı䣬ȷ��CO2�����������Ҳ���Բⶨ��Ʒ��̼��صĺ�����ʵ��ʱ������ӦΪ̼��������ᷴӦ��������ء�������̼��ˮ����Ӧ�����ӷ���ʽΪCO32����2H�� �� CO2����H2O���жϷ�Ӧ��ȫ�������ǵ�����ƽ�Ķ������ٷ����仯����ʵ�鷽������ȱ�㣺�ŵ㣺������㣻ȱ�㣺�ݳ��Ķ�����̼�к���ˮ�������Ȼ��⣬����ɽϴ�ʵ����
����4����û���ñ�Һ��ϴ�ζ��ܣ���ҺŨ�ȱ�ϡ���ζ�ʱ���ı�Һƫ�࣬��ʵ������ƫ������5��������ͼװ�ã�ͨ����Ӧǰ���������ĸı䣬ȷ��CO2�����������Ҳ���Բⶨ��Ʒ��̼��صĺ�����ʵ��ʱ������ӦΪ̼��������ᷴӦ��������ء�������̼��ˮ����Ӧ�����ӷ���ʽΪCO32����2H�� �� CO2����H2O���жϷ�Ӧ��ȫ�������ǵ�����ƽ�Ķ������ٷ����仯����ʵ�鷽������ȱ�㣺�ŵ㣺������㣻ȱ�㣺�ݳ��Ķ�����̼�к���ˮ�������Ȼ��⣬����ɽϴ�ʵ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
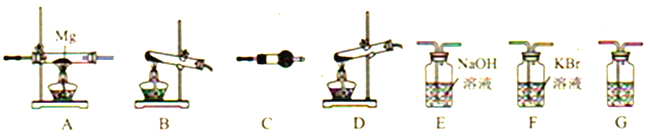
����Ŀ���������(NH4ClO4)Ϊ��ɫ���壬��ǿ�����������������������ƽ�������֪:��NH4ClO4��400��ʱ��ʼ�ֽ⣬����ΪN2��Cl2��O2��H2O����Mg3N2��ˮ�⡣������ͼ��ʾװ�����ʵ��֤���ֽ�����к���Cl2��H2O�Լ�װ��A��������Mg3N2(װ�ò��ظ�ʹ��)��
��1��д��������立ֽ�Ļ�ѧ����ʽ__________��
��2��������立ֽ�ѡ���װ����__________(����ĸ)��
��3�������������ң�װ�õ�����˳����:�ֽ�װ����_____��_____��_____��_____��_____��______________
��4��C�����ŵ��Լ���__________��G��������__________ ��
��5����֤����Cl2������������__________��
��6��Ҫ֤��װ��A��������Mg3N2��Ҫ���е�ʵ������Լ���Ӧ��ʵ��������__________��
��7��ijʵ������ŵĸ��������Ʒ�к����������ʣ���֪�������ⶨNH4ClO4�ĺ�������ⶨ��������(���ʲ��μӷ�Ӧ)������Ʒ��NH4ClO4�ĺ���(w)Ϊ__________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ������ ��
A. 1.7g�ǻ�����������ĿΪNA
B. 1L 1mol/L�ļ״�ˮ��Һ�к�����ԭ������Ϊ4NA
C. 28 g����ϩ���е�̼ԭ����Ϊ2nNA
D. ���³�ѹ�£�3.0g�����Ǻͱ�����Ļ�����к��е�ԭ������Ϊ0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷�(FeSO4��7H2O)������ԭ������ɫ������ҩ�ȣ��ڲ�ͬ�¶����ֽ�ø������������������������֪SO3��һ����ɫ���壬�۵�16.8�棬�е�44.8�棬�����Լ���ˮ�Խ�Ũ����ǿ��������Ũ���ᣬ��Ư��ijЩ�л�Ⱦ�ϣ���Ʒ��ȡ��ش���������:

(1)����ͬѧ������ͼ��ʾװ�ã�ͨ��ʵ������̷��ֽ���װ��B�пɹ۲쵽��������______________________________�������ɴ˵ó��̷��ķֽ�����к���SO2��
(2)����ͬѧ��Ϊ����ʵ����۲��Ͻ����Լ���ͬѧ����ʵ���Bװ�õ��Թܼ��ȣ�������ɫ��Ʒ����Һδ�ָ���ɫ�����֤���̷��ֽ�IJ�����____________(����ĸ)��
A.����SO2 B.���ܺ�SO2 C.һ������SO3
(3)����ͬѧ�������Ϸ����̷����ȷֽ������O2�ų���Ϊ�ˣ�����ͬѧѡ�ü���ͬѧ�IJ���ʵ��װ�ü�����װ��������װ�����̷��ֽ�������̬������н�һ����֤: 
��װ��F��������������______________________��
�ڱ���ͬѧ��ʵ��װ���У��������ӵĺ���˳��ΪA��F��____��____��____��D��H(ÿ������ֻ��ʹ��һ��)����ʵ������У�SO3�Ժ��������ⲻ�������ŵ�������____________��
��ʵ����ɺ�A�Թ��в����ĺ�ɫ������_________����֤���̷��ֽ��������O2�ļ��鷽����______________________________________________________��
����֪ʵ��ǰװ��A�Թ�����ȡ���̷�������mg������һ��ʱ��������Թ��м���������ϡ���ᣬ����Ũ��Ϊc mol/L��KMnO4��Һ�ζ�������ζ��յ�ʱ������KMnO4��Һ�����ΪVmL�����̷����ȷֽ�����У���Ԫ�ر������İٷ���Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������Һ�У����˱������Ԫ��NH4+��PO43����CO2�⣬������Ĵ���Ԫ���ǣ� ��
A. C��H��O��N B. K��Ca��Mg��P
C. K��Ca��Mg��S D. K��Ca��Mg��Fe
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Դ�Ŀ����������������ɳ�����չ����Ҫ���⡣������������Դ����
A.����B.ú̿C.��Ȼ��D.ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ�������Ʊ������Ļ���ԭ�ϡ���ش�����������
��1������Ȼ���Ʊ��ϳ���(CO��H2)�������ɺϳ�H2C2O4��
�����ӿ�H2C2O4��Һʹ5mL0.01mol/L����KMnO4��Һ��ɫ���ɲ�ȡ�Ĵ�ʩ��__________��_______________(д����)��
�����п���֤��H2C2O4���������___________��
A.H2C2O4���Էֽ�ΪCO��CO2��H2O
B.��������0.1mol/LNaHC2O4��Һ��c(HC2O4-)+c(C2O42-)<0.lmol/L
C.0.1mol/LH2C2O4��Һ25mL��������0.1mol/LNaOH��Һ50mL
D.��������0.05mol/L��H2C2O4��ҺpH��4
��2����֪����CO(g)+H2(g)![]() C(s)+H2O(g) ��H1=-130kJ/mol
C(s)+H2O(g) ��H1=-130kJ/mol
��CH4(g)![]() C(s)+2H2(g) ��H2=+76kJ/mol
C(s)+2H2(g) ��H2=+76kJ/mol
��CO2(g)+H2(g)![]() CO(g)+H20(g) ��H3=+41kJ/mol
CO(g)+H20(g) ��H3=+41kJ/mol
��CH4(g)+CO2(g)![]() 2H2(g)+2CO(g) ��H=________��
2H2(g)+2CO(g) ��H=________��
��3����2L������ͨ��3molCO2��3molCH4���ڲ�ͬ�¶����������Ͻ�Ϊ������������Ӧ��CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)��ƽ����ϵ��CH4��CO2�������������ͼ��
2H2(g)+2CO(g)��ƽ����ϵ��CH4��CO2�������������ͼ��

�������¸÷�Ӧ���Է����е�ԭ����______________��930Kʱ��ƽ�ⳣ��K=___________(������λС��)��
�������ͼ���������¶ȱ仯��ԭ��______________��
����700��1100K����ͬ�¶���ƽ��ת������CO2________CH4(�������������� С��������������)�������2���ṩ�ķ�Ӧ��������ԭ�������______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al��SO4��2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ������ڱ���ʳƷ��NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺����ش��������⣺
��1����ͬ�����£�0.1molL��1��NH4Al��SO4��2��c��NH4+��������ڡ��������ڡ���С�ڡ���0.1molL��1NH4HSO4��c��NH4+����
��2����Ϊ0.1molL��1�ļ��ֵ������Һ��pH���¶ȱ仯��������ͼ1��ʾ�� 
�����з���0.1molL��1NH4Al��SO4��2��pH���¶ȱ仯�������� �� ����pH���¶ȱ仯��ԭ������
��20��ʱ��0.1molL��1��NH4Al��SO4��2��2c��SO42������c��NH4+����3c��Al3+��=��ȡ����ֵ��
��3������ʱ����100mL0.1molL��1NH4HSO4��Һ�еμ�0.1molL��1NaOH��Һ����ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ2��ʾ�� �Է���ͼ��a��b��c��d�ĸ��㣬ˮ�ĵ���̶��������㣻��b�㣬��Һ�и�����Ũ���ɴ�С������˳���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com