
| 1 |
| 2 |
| n |
| V |
| m |
| n |
| 100mL |
| 10mL |
| 1 |
| 2 |
| 0.015mol |
| 0.1L |
| 3.66g |
| 0.015mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、提取碘水中的碘单质时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| B、把适量FeCl3饱和溶液加入适量的氢氧化钠溶液中煮沸一会儿可制取Fe(OH)3胶体 |
| C、分液操作时,首先要打开分液漏斗的上口活塞,或使活塞上的小孔与上口部的小孔对准,然后进行分液 |
| D、用加热、蒸发的方法可以除去NaCl中的CaCl2、MgCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
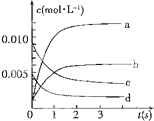 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com