
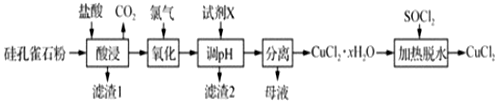
分析 以硅孔雀石[主要成分为CuCO3•Cu(OH)2、CuSiO3•2H2O,含SiO2、FeCO3、Fe2O3等杂质]加入盐酸酸浸生成二氧化碳气体,过滤得到滤渣1为SiO2 ,H2SiO3,滤液中通入氯气氧化亚铁离子为铁离子,加入氧化铜或氢氧化铜或碱式碳酸铜调节溶液PH沉淀铁离子,过滤得到滤渣2为氢氧化铁沉淀,滤液浓缩蒸发,冷却结晶得到氯化铜晶体,加入SOCl2加热脱水得到氯化铜,
(1)“酸浸”时盐酸与CuCO3•Cu(OH)2反应为复分解反应,由此确定产物配平得化学方程式为CuCO3•Cu(OH)2+4HCl═2CuCl2+CO2↑+3H2O,升高温度、加速搅拌、延长浸出时间等可以提高浸出率;
(2)硅孔雀石主要成分为CuCO3•Cu(OH)2、CuSiO3•2H2O,含SiO2、FeCO3、Fe2O3等杂质,根据流程图,加盐酸“酸浸”后溶液中只有Fe2+可被氯气氧化,“氧化”时发生反应的离子方程式为Cl2+2Fe2+═2Fe3++2Cl-;
(3)根据流程图,经氧化后溶液中阳离子主要为Cu2+和Fe3+,加试剂X调节pH使Fe3+完全沉淀而除去,Cu2+仍留在溶液中,实现Cu2+和Fe3+的分离,最终制备CuCl2;“调pH”时,pH不能过高,否则Cu2+转化为Cu(OH)2沉淀;
(4)由已知:SOCl2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+2HCl↑,“加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解.
解答 解:(1)“酸浸”时盐酸与CuCO3•Cu(OH)2反应为复分解反应,由此确定产物配平得化学方程式为CuCO3•Cu(OH)2+4HCl═2CuCl2+CO2↑+3H2O,为提高“酸浸”时铜元素的浸出率,适当提高盐酸浓度、适当提高反应温度、适当加快搅拌速率、适当延长酸浸时间,
故答案为:CuCO3•Cu(OH)2+4HCl═2CuCl2+CO2↑+3H2O;适当提高盐酸浓度、适当提高反应温度、适当加快搅拌速率、适当延长酸浸时间;
(2)硅孔雀石主要成分为CuCO3•Cu(OH)2、CuSiO3•2H2O,含SiO2、FeCO3、Fe2O3等杂质,根据流程图,加盐酸“酸浸”后溶液中只有Fe2+可被氯气氧化,“氧化”时发生反应的离子方程式为Cl2+2Fe2+═2Fe3++2Cl-,
故答案为:Cl2+2Fe2+═2Fe3++2Cl-;
(3)根据流程图,经氧化后溶液中阳离子主要为Cu2+和Fe3+,加试剂X调节pH使Fe3+完全沉淀而除去,Cu2+仍留在溶液中,实现Cu2+和Fe3+的分离,最终制备CuCl2;“调pH”时,pH不能过高,否则Cu2+转化为Cu(OH)2沉淀,
故答案为:Fe(OH)3 ;防止Cu2+转化为Cu(OH)2沉淀;
(4)由已知:SOCl2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+2HCl↑,“加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解.
故答案为:生成的HCl抑制CuCl2的水解.
点评 本题借助硅孔雀石为原料制取硫酸铜的工艺流程,考查了化学方程式书写、氧化还原反应等知识,可以根据所学知识完成,题目难度中等.


科目:高中化学 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、K+、ClO- 都可在该物质的溶液中大量共存 | |
| B. | 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 | |
| C. | 向0.1mol•L-1该物质的溶液中逐滴滴加0.1mol•L-1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示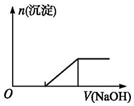 | |
| D. | 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-═2BaSO4↓+Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com