
 目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.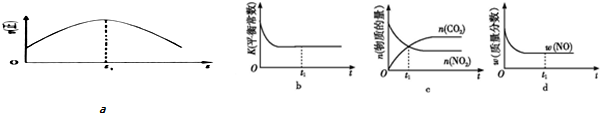
分析 (1)①根据到达平衡的时间判断温度高低,根据平衡时二氧化碳的浓度判断温度对平衡的影响,进而判断△H;
②由图可知,T2温度平衡时,二氧化碳的浓度变化量为0.1mol/L,根据v=$\frac{△c}{△t}$计算v(CO2),再根据速率之比等于化学计量数之比计算v(N2);
③A.到达平衡后正、逆速率相等,不再变化;
B.到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C.t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
D.到达平衡后各组分的含量不发生变化;
(2)①根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
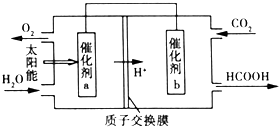
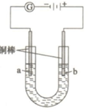
②由图可知,左室投入水,生成氧气与氢离子,电极a表面发生氧化反应,为负极,右室通入二氧化碳,酸性条件下生成HCOOH,电极b表面发生还原反应,为正极;
③计算水解平衡常数Kh,再根据Ka=$\frac{{K}_{w}}{{K}_{h}}$计算.
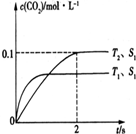
解答 解:(1)①由图1可知,温度T1先到达平衡,故温度T1>T2,温度越高平衡时,二氧化碳的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.2mol/L,故v(CO2)=$\frac{0.1mol/L}{2s}$=0.05mol/(L•s),速率之比等于化学计量数之比,故v(N2)=$\frac{1}{2}$v(CO2)=$\frac{1}{2}$×0.05mol/(L•s)=0.025mol/(L•s),
故答案为:0.025mol/(L•s);
③a.到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b.该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故b正确,
c.t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故c错误;
d.NO的质量分数为定值,t1时刻处于平衡状态,故d正确;
故答案为:bd;
(2)①已知:Ⅰ、CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
Ⅱ、2NO2(g)?N2O4(g)△H2=-56.9kJ/mol
根据盖斯定律,Ⅰ-Ⅱ得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=-867kJ/mol-(-56.9kJ/mol)=-810.1kJ/mol,
即CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),△H=-810.1kJ/mol,
故答案为:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),△H=-810.1kJ/mol;
②由图可知,左室投入水,生成氧气与氢离子,电极a表面发生氧化反应,为负极,电极反应式为2H2O-4e-═O2↑+4H+,右室通入二氧化碳,酸性条件下生成HCOOH,电极b表面发生还原反应,为正极,电极反应式为2CO2+4e-+4H+═2HCOOH,
故答案为:2CO2+4H++4e-=2HCOOH;
③常温下,0.1mol/L的HCOONa溶液pH为10,溶液中存在HCOO-水解HCOO-+H2O?HCOOH+OH-,故Kh=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1-1{0}^{-4}}$=10-7,则HCOOH的电离常数Ka=$\frac{{K}_{w}}{{K}_{h}}$=$\frac{1{0}^{-14}}{1{0}^{-7}}$=10-7,
故答案为:10-7.
点评 本题考查化学平衡图象、化学反应速率、影响化学平衡的因素、热化学方程式书写、原电池、电离平衡常数与水解平衡常数等,为高频考点,题目综合性较大,难度中等,是对知识的综合利用、注意基础知识的理解掌握,题目有助于培养学生的分析、计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 医疗上,常用碳酸钠治疗胃酸过多 | |
| B. | 在海轮外壳上安装锌块以减缓船体腐蚀 | |
| C. | 液氨汽化放出大量的热,可用作制冷剂 | |
| D. | 明矾具有强氧化性,常用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个N2分子和NA个CO分子的质量之比为1:1 | |
| B. | 水的摩尔质量等于NA个水分子的相对分子质量之和 | |
| C. | 分别由NA个水分子组成的水、冰、水蒸气的质量各不相同 | |
| D. | 1 mol N2的质量等于NA个氮原子的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
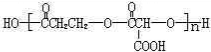 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
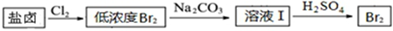
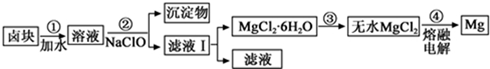
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cu2O为暗红色固体,有毒,它是一种用途广泛的材料. Y已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O ②部分难溶物的颜色和常温下的Ksp如下表所示:
Cu2O为暗红色固体,有毒,它是一种用途广泛的材料. Y已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O ②部分难溶物的颜色和常温下的Ksp如下表所示:| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol•L?1的NaCl溶液中所含Na+为NA个 | |
| B. | 标准状况下,11.2 L SO3所含的分子数为0.5NA | |
| C. | 0.1 mol CH4所含的电子数为1NA | |
| D. | 2molNO和1mol O2混合,所得气体分子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com