
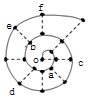
 同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 最高价氧化物对应的水化物的碱性:c<a | |
| B. | 简单离子半径:c>e>b | |
| C. | 简单离子影响水的电离能力:e>a>f | |
| D. | 单质的熔点:c>d>e |
分析 O点代表氢元素,由“蜗牛”形状可知,a为Be,b为O,c为Na,d为Si,e为S,f为Cl,
A.金属性越强,最高价氧化物对应的水化物的碱性越强;
B.电子层越多,原子半径越大,具有相同电子排布的离子中原子序数大的离子半径小;
C.弱酸或弱碱离子促进水的电离,氯离子不影响水的电离;
D.Si为原子晶体,熔点最高.
解答 解:O点代表氢元素,由“蜗牛”形状可知,a为Be,b为O,c为Na,d为Si,e为S,f为Cl,
A.金属性Na>Be,最高价氧化物对应的水化物的碱性为c>a,故A错误;
B.电子层越多,原子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则离子半径为e>b>c,故B错误;
C.弱离子促进水的电离,氯离子不影响水的电离,则简单离子影响水的电离能力:e>a>f,故C正确;
D.Si为原子晶体,熔点最高,则单质的熔点:d>c>e,故D错误;
故选C.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识及规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的O2和NO的混合物含有的分子数为0.5NA | |
| B. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 在一定条件下,2mol浓H2SO4与足量的铜充分反应,转移的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1L0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA | |
| B. | 44gCO2、N2O组成的混合气体中所含有的原子数为3NA | |
| C. | 36H2中含有的中子数目为24NA | |
| D. | 2.24L(标准状况)O2与钠反应时,转移电子数目可能为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=7的溶液中:Fe3 +、Mg2 +、SO4 2-、Cl- 能大量共存 | |
| B. | 25℃时Ksp(AgCl)=1.8×10-10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能增大 | |
| C. | 浓度均为0.1 mol•L- 1 的下列溶液,pH由大到小的排列顺序为:NaOH>Na2 CO3>(NH4 )2 SO4>NaHSO4 | |
| D. | 常温下水电离出c(H+ )×c(OH- )=10-20 的溶液中:Na+、ClO-、SO42 -、NH4 + 可能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20gD2O含有的质子数为10NA | |
| B. | 1molNa2O2与足量水反应转移的电子数为NA,生成的气体的标况下的体积为22.4L | |
| C. | 1L0.1mol/LHF溶液中含有共价键数目为0.1NA | |
| D. | NA个Fe(OH)3胶体粒子的质量为107g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S→SO3可以一步实验 | |
| B. | S是淡黄色固体,易溶于水 | |
| C. | Fe+S→FeS,Fe+Cl2→FeCl3,说明氧化性:Cl2>S | |
| D. | 试管壁上残留的S可以用酒精清洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | CO2通入NaClO 溶液中能生成HClO |
| B | 根据溶液的pH与溶液碱性的关系 | pH=6.8的溶液一定显酸性 |
| C | 组成和结构相似的物质,沸点随相对分子质量增大而升高 | H2O沸点低于H2S |
| D | 同主族元素从上至下非金属性减弱 | HF、HCl、HBr、HI的酸性依次减弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com