


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
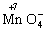 氧化为
氧化为查看答案和解析>>
科目:高中化学 来源: 题型:
A.在氧化还原反应中,甲失电子数比乙多
B.同价态阳离子,甲比乙氧化性强
C.常温下甲能与浓HNO3反应而乙不能
D.将甲、乙组成原电池时,甲为负极
查看答案和解析>>
科目:高中化学 来源:2010年福建省高二第二学期期末考试化学试题 题型:选择题
下列有关氯气的叙述中,正确的是:
A.工业上常用MnO2和浓盐酸共热来制取氯气
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.在氧化还原反应中,Cl2只能作氧化剂
D.若提供含0.4 mol HCl的浓盐酸,MnO2过量,则可制得标准状况下氯气2.24 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com