

 CH3COOH+OH-
CH3COOH+OH- CH3COOH+OH-
CH3COOH+OH-| c(H+) |
| c(CH3COOH) |
| n(H+) |
| n(CH3COOH) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
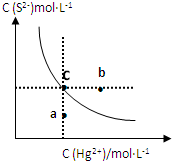 (2013?临沭县模拟)硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
(2013?临沭县模拟)硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:

 (R、R′可以是烃基或H原子)
(R、R′可以是烃基或H原子)





查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com