
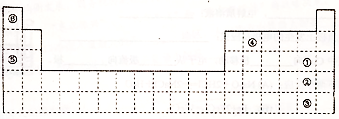
分析 根据元素在周期表中的位置可知,①为Cl,②为Br,③为I,④为C,⑤为Na,⑥为H,
(1)④为C,C的稳定的氧化物为二氧化碳,⑤为Na,Na的稳定的氧化物为过氧化钠,二氧化化碳与过氧化钠反应生成碳酸钠和氧气;
(2)根据非金属性越强,单质的氧化性越强,据此设计实验.
解答 解:根据元素在周期表中的位置可知,①为Cl,②为Br,③为I,④为C,⑤为Na,⑥为H,
(1)④为C,C的稳定的氧化物为二氧化碳,⑤为Na,Na的稳定的氧化物为过氧化钠,二氧化化碳与过氧化钠反应生成碳酸钠和氧气,反应的方程式为2 Na2O2+2 CO2=2 Na2CO3+O2,
故答案为:2 Na2O2+2 CO2=2 Na2CO3+O2;
(2)根据非金属性越强,单质的氧化性越强,证明Cl的非金属性比Br的非金属性强的实验为把Cl2通入NaBr溶液中可置换出Br2,溶液出现橙红色,则氯的非金属性比溴强,
故答案为:把Cl2通入NaBr溶液中可置换出Br2,溶液出现橙红色,则氯的非金属性比溴强.
点评 本题考查元素周期表与元素周期律综合应用,比较基础,注意对基础知识的理解掌握.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 吸热反应 | B. | 放热反应 | ||
| C. | 熵减反应 | D. | 熵增效应大于能量效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的下列叙述中,不正确的是( )
的下列叙述中,不正确的是( )| A. | 苯乙烯可以发生加聚反应 | |
| B. | 等质量苯和苯乙烯充分燃烧生成CO2的物质的量相等 | |
| C. | 苯乙烯和氢气按1:3加成 | |
| D. | 苯乙烯中所有的原子有可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 瑞典化学家舍勒在研究软锰矿(主要成份是MnO2 )的过程中,将它与浓盐酸混合物加热,产生了一种黄绿色、刺激性提心气味的气体----氯气.某学生使用这一原理设计如下图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成份是MnO2 )的过程中,将它与浓盐酸混合物加热,产生了一种黄绿色、刺激性提心气味的气体----氯气.某学生使用这一原理设计如下图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.4 mol•L-1•s-1 | B. | v (C)=0.5 mol•L-1•s-1 | ||
| C. | v (B)=0.6 mol•L-1•s-1 | D. | v (A)=0.15 mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com