
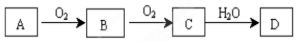
分析 题中能发生连续氧化的非金属单质A,对应的D为强酸,则对应的反应有硫和氮元素及其化合物的转化:
(1)A在常温下为淡黄色固体,是非金属单质判断A为S,B是有刺激性气味的无色气体转化关系可知为二氧化硫,则A为S元素,B为SO2,C为SO3,D为H2SO4,
①氯气具有强氧化性,二氧化硫具有还原性,在水溶液中发生氧化还原反应生成硫酸和盐酸;
②D为H2SO4,D的浓溶液与铜反应生成硫酸铜、二氧化硫和水;
(2)A在空气中的主要成分,C是红棕色的气体,则A应为N2,B为NO,C为NO2,D为HNO3,
①二氧化氮和水反应生成硝酸和NO;
②D为HNO3,稀溶液具有强氧化性,可与Cu发生氧化还原反应生成硝酸铜和NO,结合物质的性质解答该题.
解答 解:题中能发生连续氧化,对应的反应有硫和氮元素及其化合物的转化:
(1)A在常温下为淡黄色固体,是非金属单质判断A为S,B是有刺激性气味的无色气体转化关系可知为二氧化硫,则A为S元素,B为SO2,C为SO3,D为H2SO4,
①氯水和B为SO2皆可作漂白剂,若同时使用于漂白一种物质时,因为氯气具有强氧化性,二氧化硫具有还原性,在水溶液中发生氧化还原反应生成硫酸和盐酸,漂白效果减弱,反应的化学方程式为:SO2+Cl2+2H2O=2HCl+H2SO4,
故答案为:减弱; SO2+Cl2+2H2O=2HCl+H2SO4;
②D为H2SO4,D的浓溶液与铜反应的化学反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)A在空气中的主要成分,C是红棕色的气体,则A应为N2,B为NO,C为NO2,D为HNO3,
①二氧化氮和水反应生成硝酸和NO,反应的化学方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
②D为HNO3,稀溶液具有强氧化性,可与Cu发生氧化还原反应生成硝酸铜和NO,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,题目难度中等,本题注意根据物质的颜色以及连续发生氧化反应的特征为突破口进行推断.


科目:高中化学 来源: 题型:选择题
| A. | 2.24LH2O含有的分子数等于0.1NA | |
| B. | 1.12LO2和1.12LN2所含原子数一定相等 | |
| C. | 分子数为NA的CO气体质量为28克 | |
| D. | 500mL2mol/L的氯化钙溶液中Cl数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大多数合金的熔点比它的各成分金属的高 | |
| B. | 生铁和钢都是铁的合金,生铁的含碳量低于钢 | |
| C. | 日常生活中使用更多的是纯金属而不是合金 | |
| D. | 青铜是我国使用最早的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na→NaOH→Na2CO3→NaCl | B. | Al→Al2O3→Al(OH)3→AlCl3 | ||
| C. | Cu→CuCl2→Cu(OH)2→CuSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol•L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol•L-1 | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,乙中CO2的转化率大于60% | |
| B. | 平衡时,甲中和丙中H2的转化率均是60% | |
| C. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol•L-1 | |
| D. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然油脂的主要成分是高级脂肪酸 | |
| B. | 分馏、干馏都是物理变化,裂化、裂解都是化学变化 | |
| C. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| D. | 乙酸与乙醇可以发生酯化反应,又均可与金属钠发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
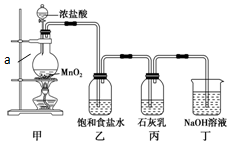 某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物.
某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
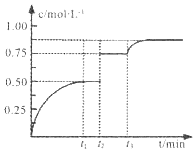 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )| A. | 反应方程式中的x=1 | |
| B. | t2时刻改变的条件是使用催化剂 | |
| C. | t3时刻改变的条件是移去少量物质C | |
| D. | t1~t3间该反应的平衡常数均为4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com