
在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol•L﹣1和1.5mol•L﹣1,现向该溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是()
A. 反应后溶液中Fe3+物质的量为0.8mol
B. 反应后产生13.44L H2(标准状况)
C. 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol
D. 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
考点: 化学方程式的有关计算;铁盐和亚铁盐的相互转变.
专题: 计算题.
分析: Fe(NO3)3和H2SO4的物质的量分别为0.2mol、1.5mol,n(Fe)=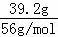 =0.7mol,氧化性为HNO3>Fe3+>H+,先发生Fe+4H++NO3﹣═Fe3++NO↑+2H2O、再发生Fe+2Fe3+═3Fe2+,若还有Fe剩余,则最后发生Fe与氢离子的反应,以此来解答.
=0.7mol,氧化性为HNO3>Fe3+>H+,先发生Fe+4H++NO3﹣═Fe3++NO↑+2H2O、再发生Fe+2Fe3+═3Fe2+,若还有Fe剩余,则最后发生Fe与氢离子的反应,以此来解答.
解答: 解:Fe(NO3)3和H2SO4的物质的量分别为0.2mol、1.5mol,n(Fe)=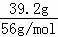 =0.7mol,氧化性为HNO3>Fe3+>H+,则
=0.7mol,氧化性为HNO3>Fe3+>H+,则
Fe+4H++NO3﹣═Fe3++NO↑+2H2O
1 4 1 1
4 1 1
0.6 2.4 0.6 0.6
Fe+2Fe3+═3Fe2+,
1 2 3
0.1 0.2 0.3
Fe完全反应,没有剩余,溶液中存在0.6molFe3+、0.3molFe2+,
A.反应后溶液中Fe3+物质的量为0.6mol,故A错误;
B.不发生Fe+2H+═Fe2++H2↑,没有氢气生成,故B错误;
C.反应后溶液中存在0.6molFe3+、0.3molFe2+,反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol,故C正确;
D.氧化性为HNO3>Fe3+>H+,先发生Fe+4H++NO3﹣═Fe3++NO↑+2H2O,有气体生成,故D错误;
故选C.
点评: 本题考查铁的化学性质及化学反应的计算,明确发生的化学反应及反应的先后是解答本题的关键,注意过量计算来解答,题目难度不大.


科目:高中化学 来源: 题型:
在不同条件下,分别测得反应2SO2+O2⇌2SO3的速率如下,其中最快的是()
A. v(SO3)=4 mol•L﹣1•min﹣1 B. v(O2)=2 mol•L﹣1•min﹣1
C. v(SO2)=5 mol•L﹣1•min﹣1 D. v(SO2)=0.1 mol•L﹣1•S﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
100mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42﹣的物质的量浓度约为()
A. 0.20mol/L B. 0.25mol/L C. 0.4mol/L D. 0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
VL Fe2(SO4)3溶液中含有Fe3+mg,则溶液中SO42﹣的物质的量浓度为()
A. 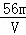 mol/L B.
mol/L B. 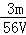 mol/L C.
mol/L C. 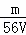 mol/L D.
mol/L D. 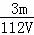 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
在c(H+):c(OH﹣)=1:2的水溶液中能大量共存的离子组是()
A. K+、Al3+、HCO3﹣、SO42﹣ B. Ca2+、NH4+、CO32﹣、Cl﹣
C. Na+、K+、NO3﹣、ClO﹣ D. Na+、Fe2+、I﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
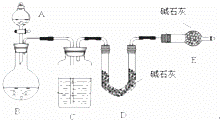
某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数.
【方法一】测 SO2质量法采用如图所示装置,通过实验测定生成SO2的质量.
(1)C中盛放的试剂是 ,E装置的作用是
(2)若实验前称取m1g样品,再测得SO2的质量为m2g,则可得Na2SO4质量分数,其中m2是通过测定 (填装置符号)装置在实验前后的质量差得到的.该方法的缺点是(只答一点).
【方法二】测沉淀质量法
第一步:称取m3g样品,置于小烧杯中 第二步:向小烧杯中加入足量稀盐酸,加热
第三步:再向小烧杯中加入足量BaCl2溶液,然后过滤、洗涤 第四步:干燥沉淀,称重为m4g
(3)简述洗涤沉淀的方法: .
(4)若m3=2m4 则试样中Na2SO4的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原子结构和元素周期律的表述正确的是()
①原子序数为15的元素的最高化合价为+3
②第ⅦA族元素是同周期中非金属性最强的元素
③第ⅥA族元素的原子最高正价等于主族序数
④原子序数为12的元素位于元素周期表的第三周期第ⅡA族.
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的极,发生的电极反应为 .
(2)该电池工作时(放电)反应的总化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)⇌cC(g)+dD(g),取a mol A和b mol B置于V L的容器中,1min后,测得容器内A的浓度为x mol•L﹣1,这时B的浓度为( ﹣)mol•L﹣1,C的浓度为 mol•L﹣1.这段时间内反应的平均速率若以物质A的浓度变化来表示,应为 mol•L﹣1•min﹣1.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com