
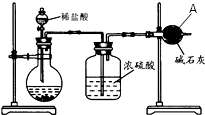
 为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)
为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)分析 (1)装置图分析仪器A是干燥管;
(2)根据酸碱中和滴定中氢氧化钠消耗的氯化氢计算出碳酸钙反应消耗的氯化氢,再根据碳酸钙与氯化氢反应的关系式计算出碳酸钙的物质的量、质量及样品中碳酸钙的质量分数;
(3)碳酸钙高温煅烧得到的氧化钙和空气中水蒸气、二氧化碳发生反应,影响测定准确性;
(4)加入过量盐酸,碳酸钙全部溶解为氯化钙溶液,加入过量碳酸钠会沉淀钙离子为碳酸钙沉淀,所以最后洗涤干燥得到的沉淀质量即为样品中碳酸钙质量,计算得到质量分数;
(5)分析判断可知方案Ⅱ测定结果更准确;方案Ⅰ称量操作复杂,易造成误差.方案Ⅲ温度难于在实验室中达到.
解答 解:(1)仪器A的名称为干燥管,用于测定生成二氧化碳的质量,故答案为:干燥管;
(2)碳酸钙消耗的氯化氢的物质的量为:0.1L×1mol/L-10×0.1000mol/L×0.015L=0.085mol,
碳酸钙与氯化氢反应的关系式为:CaCO3~2HCl,碳酸钙的物质的量为:0.085mol×$\frac{1}{2}$=0.0425mol,
所以样品中碳酸钙的质量分数为:$\frac{0.0425mol×100g/mol}{5.0g}$×100%=85%,
故答案为:85.0%;
(3)高温煅烧1000℃直至质量不再改变碳酸钙分解生成氧化钙和二氧化碳,“冷却”应在干燥器中进行防止生成的氧化钙与空气中的H2O、CO2反应,造成质量改变而产生误差;
故答案为:防止生成的氧化钙与空气中的H2O、CO2反应,造成质量改变而产生误差;
(4)加入过量盐酸,碳酸钙全部溶解为氯化钙溶液,加入过量碳酸钠会沉淀钙离子为碳酸钙沉淀,所以最后洗涤干燥得到的沉淀质量即为样品中碳酸钙质量,计算得到质量分数,需要数据是称取碳酸钙样品m g,④中的沉淀滤出、洗涤、干燥、称重为bg,所以不需要的是:B.c、V 和C.c′、V′;
故答案为:B C;
(5)通过对比题中两个方案可知,方案Ⅱ测定结果更准确;而方案Ⅰ中,沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差,或回答①装置中原有的CO2 也被碱石灰吸收;②反应产生的CO2 未被完全吸收;③空气中的H2O和CO2 也被碱石灰吸收;④加入的硫酸的量不足,未能将碳酸钠完全反应;⑤装置的气密性不好等;或Ⅲ实验室难于提供1000℃的高温;
故答案为:Ⅱ;Ⅰ;气体质量难以测量准确或回答①装置中原有的CO2 也被碱石灰吸收;②反应产生的CO2 未被完全吸收;③空气中的H2O和CO2 也被碱石灰吸收;④加入的硫酸的量不足,未能将碳酸钠完全反应;⑤装置的气密性不好等;或Ⅲ;实验室难于提供1000℃的高温.
点评 本题考查了探究碳酸钙样品的含量、性质实验方案的设计与评价,题目难度中等,注意掌握实验过程中的数据分析与应用方法,明确评价实验方案的原则.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②③⑤ | C. | ③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,18gD2O中所含的质子数为10NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| C. | 28gN2和CO的混合气体中含有的分子数为NA | |
| D. | 5.6g铁与足量稀硫酸反应失去电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgF2 | B. | CaCl2 | C. | K2S | D. | Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ①④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-x-2}{W-m}$ mol | B. | $\frac{W(m-x)}{m}$ mol | C. | $\frac{W(m-x-2)}{m}$mol | D. | $\frac{W(m-x+2)}{m}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3和CaSO4都属于盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Fe(OH)3都属于碱 | D. | Na2O和Na2SiO3都属于氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com