
| △c |
| t |
| 2mol/L-1.8mol/L |
| 2min |
| 2mol/L-1.6mol/L |
| 2min |
| 0.6mol/L |
| 2min |
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 2 |
| 1 |
| 3 |


科目:高中化学 来源: 题型:
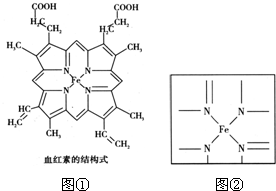

查看答案和解析>>
科目:高中化学 来源: 题型:
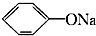 ④CH3COONH4 ⑤NH4HCO3
④CH3COONH4 ⑤NH4HCO3 >HCO3-.常温下,物质的量浓度相同的①、②、③溶液pH由大到小顺序为(填序号)
>HCO3-.常温下,物质的量浓度相同的①、②、③溶液pH由大到小顺序为(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O |
| B、NaHCO3溶液中加入稀盐酸:CO32-+2H+═CO2↑+H2O |
| C、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2S、HCl的热稳定性依次增强 |
| B、金刚石的熔沸点高于晶体硅 |
| C、NaF、NaCl、NaBr、NaI的熔点依次降低 |
| D、CH4、SiH4、GeH4、SnH4的沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com