
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其新的合成方法之如下:CH3-C≡CH+CH3OH+A![]() CH2=C(CH3)COOCH3,下列说法正确的是
CH2=C(CH3)COOCH3,下列说法正确的是
A. 已知该反应的原子利用率为100%,则A为CO2
B. CH2=C(CH3)COOCH3分子中所有碳原子一定共面
C. 该方法的优点是原料无爆炸危险
D. CH3- C![]() CH与丙烯的化学性质相似,可以发生加成、氧化反应
CH与丙烯的化学性质相似,可以发生加成、氧化反应
【答案】D
【解析】
A.已知该反应的原子利用率为100%,则产物只有CH2=C(CH3)COOCH3,根据质量守恒定律可以判断A为CO,不可能是CO2,A不正确;
B.根据乙烯的平面结构可知,结构中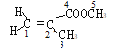 的1 、2 、3、 4号四个碳原子一定共平面,而5号碳与之可能共平面,B不正确;
的1 、2 、3、 4号四个碳原子一定共平面,而5号碳与之可能共平面,B不正确;
C. 已知该反应的原子利用率为100%,则产物只有CH2=C(CH3)COOCH3,根据质量守恒定律可知A为一氧化碳,一氧化碳、丙炔等都属于可燃性气体,存在爆炸危险,C错误;
D. CH3-C≡CH的官能团为碳碳三键,丙烯的官能团为碳碳双键,两者都属于不饱和烃,其性质与丙烯的性质相似,丙烯能发生加成反应和氧化反应,所以该物质可以发生加成、氧化反应,D正确。
综上所述,本题选D。


科目:高中化学 来源: 题型:
【题目】(1)下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,既含有离了键,又含有共价键的物质是_____,属于共价化合物的是__________。
(2)用电子式表示CaCl2的形成过程:________________。
(3)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用产生NH3。请写出NH3的电子式是____________。
(4)Na3N与盐酸反应生成两种盐,反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述错误的是( )
A. 常温常压下,3.6 g H2O中所含电子数为2NA
B. 1 mol NH4HCO3晶体中,含有NH4+、NH3和NH3·H2O的总数为NA
C. 标准状况下,22.4LO2和22.4LNO混合后所得气体分子数小于1.5NA
D. 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO- 数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-===Fe2++I2
B. 硫酸溶液与氢氧化钡溶液反应:Ba2++SO42- ===BaSO4↓
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D. 氯化铝溶液与过量氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
【答案】D
【解析】A. 氯化铁溶液中的铁离子具有氧化性,能够氧化碘离子,与碘化钾溶液反应的离子方程式为2Fe3++2I-===2Fe2++I2,故A错误;B. 硫酸溶液与氢氧化钡溶液反应生成硫酸钡沉淀和水,离子方程式为Ba2++SO![]() +2H++2OH-=2H2O+BaSO4↓,故B错误;C. 醋酸是弱酸,用化学式表示,故C错误;D. 氯化铝溶液与过量氨水反应生成氢氧化铝沉淀,过量的氨水不能溶解氢氧化铝,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH
+2H++2OH-=2H2O+BaSO4↓,故B错误;C. 醋酸是弱酸,用化学式表示,故C错误;D. 氯化铝溶液与过量氨水反应生成氢氧化铝沉淀,过量的氨水不能溶解氢氧化铝,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH![]() ,故D正确;故选D。
,故D正确;故选D。
【题型】单选题
【结束】
12
【题目】一定条件下密闭容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g),能说明该反应达到化学平衡状态的是( )
2NH3(g),能说明该反应达到化学平衡状态的是( )
A. N2、H2、NH3的浓度相等 B. N2、H2、NH3的浓度不再变化
C. N2、H2、NH3在密闭容器中共存 D. 反应停止,正、逆反应速率都等于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分:

根据要求回答下列问题:
(1)十种元素中化学性质最不活泼的元素是__________________(填元素符号,下同),形成化合物种类最多的元素是_____________________。
(2)A、C、D三种元素的最高价氧化物对应的水化物,其中碱性最强的是______________(填化学式,下同),E、H、G三种元素的最高价氧化物对应的水化物中酸性最强的是______________。
(3)I元素跟A元素形成化合物的电子式是______________。高温灼烧该化合物时,火焰呈______________色。
(4)分别写出B、G两种单质和水反应的离子方程式_____________、________________。
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在一定条件下反应,可以制得较纯净的1,2-二氯乙烷的是
A.乙烷与氯气混合B.乙烯与氯化氢气体混合
C.乙烯与氯气混合D.乙烯通入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能光伏电池可通过并网,使用半导体照明(LED);已知发出白光的LED是由GaN芯片和钇铝石榴石(Y3Al5O12)芯片封装在一起做成的。下列有关叙述正确的是
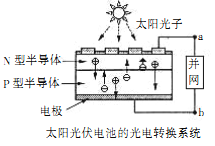
A. 光伏电池实现了太阳能和电能的相互转化
B. 图中N型半导体为正极,P型半导体为负极
C. LED是新型有机高分子材料
D. LED中的Ga和Y都显+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存方法错误的是( )
A.实验室少量的钠保存在煤油中B.浓硝酸保存在无色细口玻璃瓶中
C.存放FeSO4溶液时加入少量铁粉D.NaOH溶液保存在橡皮塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氧化铋在汽车装饰,电子设备等生活方面有广泛的应用。利用铜转炉烟尘(主要为含铋的化合物,另外还含Cu、Pb、Bi的硫酸盐及CuS、Fe2O3)可生产氯氧化铋,其工艺流程如下:

(1)提高“酸浸”反应速率的措施有适当增加硫酸的浓度和_____________。
(2) “浸渣1”中除铋的化合物外,还有的物质是_______________(填化学式)
(3) “浸液1”中加入过量锌粉,作用是____________________;反应完毕后,过滤,从滤液中得到ZnSO4·7H2O晶体的操作有________、________、过滤、洗涤、干燥。
(4)“浸铜”时,有单质硫生成,写出生成硫的离子方程式________________________
(5)“浸铋”时,在室温和液固比(盐酸、NaCl溶液组成的混合溶液的质量与“浸渣2”的质量的比值)固定的条件下,c(HCl)=1 mol·L-1时,铋的浸出率和Cl-浓度的关系如下图所示,其中NaCl的作用是_________,若升高温度,铋的浸出率反而下降,其可能的原因是__________________________________。

(6)“沉铋”时需要控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com