
| A.MgCl2 | B.CaCl2 | C.SiO2 | D.CS2 |
科目:高中化学 来源:不详 题型:填空题

 cm,则距离最近的M、N离子间的距离为
cm,则距离最近的M、N离子间的距离为查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X2-的还原性一定大于Y- |
| B.由mXa+与nYb-得m+a = n-b |
| C.X、Y一定不是同周期元素 |
| D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
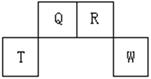
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.6 | 0.75 | 0.82 |
| 最高或最低化合价 | | +2 | +1 | +5 | +7 | +1 | +5 | +3 |
| -2 | | | -3 | -1 | | -3 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铊是易导电的银白色金属 | B.铊能生成+3价的离子 |
| C.Tl3+的氧化能力比Al3+强 | D.氢氧化铊的碱性比氢氧化铝强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3号到9号元素化合价的变化与11到17号元素化合价的变化完全相同 |
| B.同周期原子半径逐渐减小,所以离子半径也逐渐减小 |
| C.随着原子序数的递增,碱金属元素单质的还原性逐渐增强,阳离子的氧化性逐渐减弱 |
| D.甲乙电子层数相同,甲的最高价氢氧化物的碱性比乙的最高价氢氧化物的碱性强,说明甲的核电荷数比乙大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com