
【题目】将无机碳转化为有机化合物是目前研究的热点,也是减少CO2和CO的有效措施之一,对环境的保护起到了积极作用。
I.二氧化碳催化加氢甲烷化工艺是利用氨还原CO2,反应为CO2(g)+4H2(g)![]() CH4(g)+2H2O(l)H1。
CH4(g)+2H2O(l)H1。
(1)已知:H2(g)的燃烧热H2=-285.8kJ·mol-1,CH4(g)的燃烧热H=-890.3kJ·mol-1,则△H1=________kJ·mol-1。
(2)测得该反应的吉布斯自由能(G=H-TS)随温度的变化曲线如图甲所示,为使CO2顺利转化为CH4,反应应在___下进行。

II.一氧化碳催化加氢制甲醇:CO(g)+2H2(g)![]() CH2OH(g)。
CH2OH(g)。
(3)图乙是反应中部分物质的浓度随时间t的变化情况,0~10min内,用H2表示的平均反应速率v(H2)=_____,该反应平衡常数的表达式为_______________。

(4)在容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图丙所示。
①p1______(填“>”“<”或“=”)p2。
②比较图丙中A、C两点,平衡常数KA__________(填“>”“<”或“=")KC。
③若达到化学平衡状态点A时,容器的体积为20L,T1℃时平衡常数KA=______
【答案】-252.9 温度低于870K 0.15mol·L-1·min-1 ![]() < > 4
< > 4
【解析】
(1)H2(g)的燃烧热H2=-285.8kJ·mol-1,则有H2(g)+![]() O2(g)=H2O(l)H2=-285.8kJmol-1 反应a;
O2(g)=H2O(l)H2=-285.8kJmol-1 反应a;
CH4(g)的燃烧热H=-890.3kJ·mol-1,则有CH4(g)+2O2(g)═CO2(g)+2H2O(l)H=-890.3KJmol-1 反应b;
根据盖斯定律:a×4-b可得CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) H1=(-285.8kJmol-1)×4-(-890.3KJmol-1)=-252.9 kJmol-1;
CH4(g)+2H2O(l) H1=(-285.8kJmol-1)×4-(-890.3KJmol-1)=-252.9 kJmol-1;
(2)G<0时反应才有自发性,据图可知温度低于870K时G<0;
(3)据图可知图示两种物质单位时间内浓度变化量相等,根据方程式可知应为CO和CH3OH的物质的量浓度变化曲线,10min内CO或CH3OH的浓度变化均为0.75mol/L,则c(H2)=1.5mol/L,所以v(H2)=![]() =0.15mol·L-1·min-1;根据平衡常数的定义可知该反应的平衡常数表达式为K=
=0.15mol·L-1·min-1;根据平衡常数的定义可知该反应的平衡常数表达式为K=![]() ;
;
(4)①据图可知相同温度下p2压强下CO的转化率更大,该反应为气体体积减小的反应,压强越大转化率越大,所以p1<p2;
②等压条件下温度越高CO的转化率越小,说明温度升高平衡逆向移动,正反应为放热反应,温度越高平衡常数越小,所以KA>KC;
③A点CO的转化率为50%,初始投料为10molCO和20molH2,容器体积为20L,列三段式有:

平衡常数KA=![]() =4。
=4。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.NaOH溶液需要用胶塞试剂瓶盛装:SiO2+2Na++2OH-=Na2SiO3+H2O
B.铝与浓硫酸反应:2Al+6H+=2Al3++3H2↑
C.检验![]() 涉及的反应:
涉及的反应:![]() +OH-
+OH-![]() NH3·H2O
NH3·H2O
D.硫代硫酸钠与稀硫酸反应:![]() +2H+=S↓+SO2↑+H2O
+2H+=S↓+SO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含MgCl2和AlCl3各0.01 mol,向其中逐滴滴加1 mol/L的NaOH溶液至过量,下列关系图正确的是( )

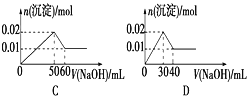
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是元素周期表的轮廓图,根据元素①~⑩在周期表中的位置,按题目要求回答问题:
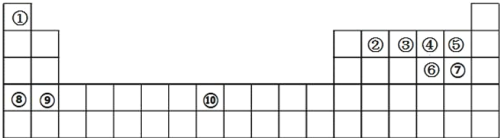
(1)元素①、②能形成 16 电子的分子,该分子的电子式为________________, 元素①、③能形成 10 电子的分子,请用电子式表示该物质的形成过程_______________________;
(2)元素④、⑤、⑥形成的简单氢化物的热稳定性从小到大顺序为___________________(用化学式表示);
(3)将过量的元素⑩单质加入到元素③最高价氧化物水化物的稀溶液中,发生反应的离子反应方程式为_______;
(4)铅元素在元素周期表中的位置为________________,铅酸蓄电池是典型的二次电池,在生活中有广泛的应用,其放电时正极的电极反应式为________________,放电一段时间后,正极质量增加 6.4g,则这段时间,转移电子物质的量为__________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 除去NaHCO3固体中混有的NH4HCO3 | 直接将固体加热 |
B | 实验室收集NO2气体 | 用排水集气法收集 |
C | 检验非金属性Cl>C | 在Na2CO3溶液中加入足量HCl |
D | 检验某溶液中是否有 | 取该溶液于试管中,加入NaOH溶液后加热,用湿润的红色石蕊试纸检验 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态C原子中,核外存在_______对自旋方向相反的电子。
(2)丙酮(![]() )分子中,中间碳原子的杂化方式为______;
)分子中,中间碳原子的杂化方式为______;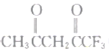 中
中![]() 键和π键的数目之比为__________________.
键和π键的数目之比为__________________.
(3)写出两个与CO2具有相同空间构型的分子或离子:_____________
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____晶体;Fe3+的核外电子排布式为__________________。
(5)已知第IIA族元素的碳酸盐MCO3热分解的主要过程为M2+结合碳酸根离子中的O2-,释放出CO2。则CaCO3的分解温度低于BaCO3的原因是_______________。分子中的大π键用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则CO32-中的大π键应表示为____________。
),则CO32-中的大π键应表示为____________。
(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
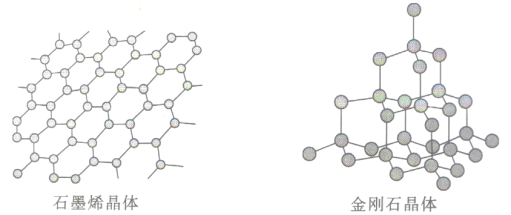
①在石墨烯晶体中,一个六元环上的C原子数为__________________。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接_____个六元环,六元环中最多有_______个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,2.24 L![]() 中含有碳碳双键数为0.3NA
中含有碳碳双键数为0.3NA
B. 0.1mol甲烷和乙烯组成的混合气体完全燃烧,生成的水分子数为0.2NA
C. 0.1molCH4与0.1molCl2混合充分光照,生成CH3Cl分子数为0.1 NA
D. 0.1molN2和0.3molH2在高温、高压及催化剂下充分反应,产物的分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用含铅废料(主要含PbO、PbSO4和PbO2)制备化工产品(PbSO4·3PbO·H2O)的工艺流程如图:
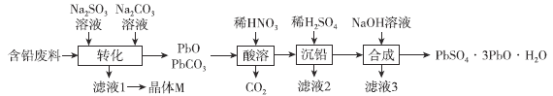
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。请回答下列问题:
(1)“转化”时,加入Na2CO3的目的是将PbSO4转化成PbCO3,其转化原理是___________。PbO2转化为PbCO3的离子方程式为_________。
(2)该流程中可以循环利用的物质是_________,若其中残留过多SO42-,循环利用可能出现的问题是__________。
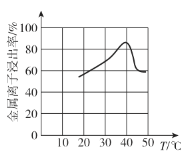
(3)一定浓度的硝酸溶解PbCO3和PbO时,“酸溶”时,金属离子浸出率与温度的关系如图所示。当温度为40℃,金属离子浸出率最高,其主要原因是________。
(4)取一定量的含铅废料经上述“转化”,假设含铅废料中的PbO2和PbSO4全部转化成PbCO3,且PbO未发生反应,“酸溶”时共收集到5.6 L CO2(标准状况),“沉铅”时得到121.2 g PbSO4。
①原含铅废料中含PbO的物质的量为__________。
②“合成”时,加入NaOH的质量为__________。
(5)工业上,电解Pb(NO3)2溶液制备活性电极材料PbO2,其阳极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。
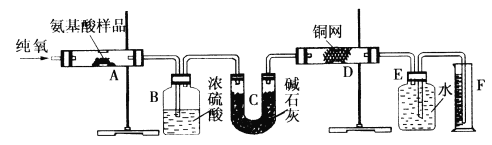
回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com