
分析 氨水中存在:NH3•H2O?NH4++OH-,加水稀释促进一水合氨电离,加入含有铵根离子或氢氧根离子的物质抑制一水合氨电离,加入和铵根离子或氢氧根离子反应的物质促进一水合氨电离,据此分析.
解答 解:(1)加水稀释促进一水合氨电离,加入浓氨水,一水合氨浓度增大平衡正向移动,加入浓硫酸,和氢氧根离子反应促进一水合氨电离,所以促进一水合氨电离的是ABD;
加入少量氢氧化钠,c(OH-)增大抑制一水合氨电离,加入少量氯化铵,c(NH4+)增大,抑制一水合氨电离,所以抑制一水合氨电离的是CE;
故答案为:ABD;CE;
(2)向溶液中加入浓氨水,促进一水合氨电离,溶液中c(NH4+)、c(OH-)都增大;
向溶液中加入水,促进一水合氨电离,但铵根离子或氢氧根离子增大的倍数小于溶液体积增大的倍数,所以c(NH4+)、c(OH-)都减小;
故答案为:A;B;
(3)向溶液中加入氯化铵,铵根离子浓度增大抑制一水合氨电离,则氢氧根离子浓度减小;向溶液中加入硫酸,消耗氢氧根离子,溶液中氢氧根离子浓度减小,促进一水合氨电离,则铵根离子浓度增大;
故答案为:DE;
(4)能使c(OH-)增大、c(NH4+)减少,应加入碱,即加NaOH,C(OH-)增大,平衡逆向移动,C(NH4+)减小;
故答案为:C.
点评 本题考查弱电解质的电离,侧重于学生的分析能力的考查,注意把握影响弱电解质的因素以及弱电解质的电离特点,注意相关基础知识的积累,难度不大.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对硫一氮化合物的研究是最为活跃的领域之一.如图是已经合成典型的硫-氮化合物的分子结构.下列说法正确的是( )
对硫一氮化合物的研究是最为活跃的领域之一.如图是已经合成典型的硫-氮化合物的分子结构.下列说法正确的是( )| A. | 该物质的分子式为SN | B. | 该物质具有很高的熔、沸点 | ||
| C. | 该分子是非平面的八元环结构 | D. | 该物质与S2N2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
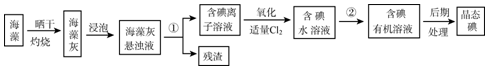
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
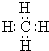 ,AxByCz的分子式AlC3H9.
,AxByCz的分子式AlC3H9.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时Pb为负极,此时溶液中的SO42-向Pb电极迁移 | |
| B. | 铅蓄电池电解CuCl2溶液,若制得2.24LCl2(标准状况),这时电池内消耗的H2SO4至少0.2mol | |
| C. | 放电完全后铅蓄电池可进行充电,此时铅蓄电池的负极连接外电源的正极上 | |
| D. | 充电时阳极的电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com