
(6��)��ҵ�ϳ�����Ȼ����Ϊ�Ʊ�CH3OH��ԭ�ϡ���֪��
��CH4(g)+O2(g)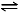 CO(g)+H2(g)+H2O(g) ��H=��321.5 kJ/mol
CO(g)+H2(g)+H2O(g) ��H=��321.5 kJ/mol
��CH4(g)+ H2O(g) 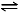 CO(g)+3H2(g) ��H=��250.3 kJ/mol
CO(g)+3H2(g) ��H=��250.3 kJ/mol
��CO(g)+2H2(g) 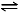 CH3OH(g) ��H=��90.0 kJ/mol
CH3OH(g) ��H=��90.0 kJ/mol
��1��CH4(g)��O2(g)��Ӧ����CH3OH(g)���Ȼ�ѧ����ʽΪ_____________��
��2����V L�����ܱ������г���a mol CO��2a mol H2���ڲ�ͬѹǿ�ºϳɼ״���CO ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��

��ѹǿP1____P2���������������������
����100�桢P1ѹǿʱ��ƽ�ⳣ��Ϊ________(�ú�a��V�Ĵ���ʽ��ʾ)��
��1��2CH4(g)+O2(g)  2CH3OH(g) ��H=��251.2 kJ/mol ��2���٣� ��V2/a2
2CH3OH(g) ��H=��251.2 kJ/mol ��2���٣� ��V2/a2
��������
�������:��1����CH4��g��+O2��g��?CO��g��+H2��g��+H2O��g����H=-321.5kJ/mol����CH4��g��+H2O��g��?CO��g��+3H2��g����H=+250.3kJ/mol����CO��g��+2H2��g��?CH3OH��g����H=-90kJ/mol�����ݸ�˹���ɣ���+��-2���۵õ���2CH4��g��+O2��g��=2CH3OH��g����H=-251.2KJ/mol���ʴ�Ϊ��2CH4��g��+O2��g��=2CH3OH��g����H=-251.2KJ/mol����2������ͼ���֪����ͬ�¶���P2ѹǿ��һ����̼ת���ʴ���P1ѹǿ��һ����̼ת���ʣ���Ӧ�����������С�ķ�Ӧ��ѹǿ����ƽ��������У�����P1��P2���ʴ�Ϊ����������VL�����ܱ������г���a mol CO��2a mol H2��100��Cʱһ����̼��ת����Ϊ50%����COŨ�ȱ仯��Ϊ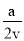 mol/L����ƽ�ⳣ��Ϊ V2/a2
mol/L����ƽ�ⳣ��Ϊ V2/a2
���㣺��ѧƽ��


 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ��ͷ�и߶���ѧ���¿���ѧ�������Ծ��������棩 ���ͣ�ѡ����
�ڳ�����Cu(OH)2��Ksp��2��10��20��ijCuSO4��Һ��c(Cu2��)��0.02mol/L���ڳ��������Ҫ����Cu(OH)2��������Ҫ��CuSO4��Һ�м������Һ��������Һ��pH��Ӧ��ʹ��Һ��pH����
A��8 B��9 C��4 D��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����и߶���ѧ�����п��Ի�ѧ���ģ��Ծ��������棩 ���ͣ������
��6�֣���ҵ�����ù����������ȡ�赥�ʣ���Ҫ��ӦΪ��SiO2 + 2C  Si + 2CO�����÷�Ӧ�У���ԭ���� ���ѧʽ��������ԭ�������� ���ѧʽ��������Ӧ��������1 mol C�������� mol Si��
Si + 2CO�����÷�Ӧ�У���ԭ���� ���ѧʽ��������ԭ�������� ���ѧʽ��������Ӧ��������1 mol C�������� mol Si��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����и߶���ѧ�����п��Ի�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
�����й����ʶ��˵���У���ȷ����
A�������ķϵ��Ӧ�ü��л��մ���
B����Ȼ��֭�в����κλ�ѧ����
C������ɫʳƷ����ָ��ɫһ��Ϊ��ɫ��ʳƷ
D������ɫ��Ⱦ����ָ��ɫ�۳���ɵ���Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����и߶���ѧ�����п��Ի�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
���������У�����ɫ����
A��N2 B��Cl2 C��CO2 D��SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����и߶���ѧ�����п��Ի�ѧ�������Ծ��������棩 ���ͣ�ѡ����
��2L�ܱ������У�����X��Y��4mol��һ�������·�����ѧ��Ӧ��
2X��g��+ 2Y��g��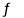 Z��g��+2 W��g�� ��H<0�� ��Ӧ���е�5sʱ���X��ת����Ϊ25%��10 s��ﵽ��ѧƽ�⣬���Z��Ũ��Ϊ0.5mol/L��������˵����ȷ����
Z��g��+2 W��g�� ��H<0�� ��Ӧ���е�5sʱ���X��ת����Ϊ25%��10 s��ﵽ��ѧƽ�⣬���Z��Ũ��Ϊ0.5mol/L��������˵����ȷ����
A��5s��ƽ����Ӧ����Ϊ��(Y)= 0.2 mol/( L��s)
B���÷�Ӧ��ƽ�ⳣ����ֵΪ0.5
C�������ݻ�������䣬��������ͨ������������߷�Ӧ���ת����
D�������¶ȣ�������������ܶȲ���ʱ����ʾ�÷�Ӧ�Ѿ��ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����и߶���ѧ�����п��Ի�ѧ�������Ծ��������棩 ���ͣ�ѡ����
0.100 mL 6 mol��L-1 H2SO4������п�۷�Ӧ����һ���¶��£�Ϊ�˼�����Ӧ���ʣ����ֲ�Ӱ����������������������Ӧ���м����������������еģ��������ƹ��� ��ˮ ���������Һ ���������Һ �ݴ����ƹ��� ������ͭ����
A���ڢۢ� B���٢ܢ� C���ڢۢ� D���ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015���ɹ��������и߶���ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ������
(12��)�����£���a mol O2��bmol SO2�Ļ������ͨ��һ���̶��ݻ����ܱ������У��������·�Ӧ��
O2 (g) + 2SO2(g)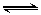 2SO3(g)
2SO3(g)
��һ��������Ӧ��ƽ��ʱ��n (O2) = 4mol��n(SO3) = 4mol,����a��ֵΪ ��
��ƽ��ʱ������ڱ�״��Ϊ313.6L��ԭ���������ƽ��������������ʵ���֮��(д����������ȣ���ͬ)��n(ʼ)��n(ƽ) = ��
�۴ﵽƽ��ʱ��O2��SO2��ת����֮�ȣ���(O2)�æ� (SO2)= ��
����������ʼ��6mol O2��b mol SO2��1 molSO3ͨ���Ϸ�Ӧ�����У���ʼ��Ӧ����������У�ʹ��Ӧ�ﵽƽ��ʱ��������������ʵ���Ϊ12mol����b��ȡֵ��Χ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡ�߶�1���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪ij�¶�ʱCH3COOH�ĵ���ƽ�ⳣ��ΪK�����¶�����20 mL 0.1 mol/L CH3COOH��Һ����μ���0.1 mol/L NaOH��Һ����pH�仯������ͼ��ʾ(�����¶ȱ仯)��

����˵������ȷ����
A��a���ʾ��Һ��c(CH3COO��)ԼΪ10-3 mol/L
B��b���ʾ����Һ��c(Na��)��c(CH3COO��)
C��c���ʾCH3COOH��NaOHǡ�÷�Ӧ��ȫ
D��d���ʾ����Һ�� ����K
����K
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com