
【题目】常温下,将20.0g14.0%的NaCl溶液跟30.0g24.0%的NaCl溶液混合,得到密度为1.15g/cm3的混合溶液。求:
(1)该混合溶液的质量分数为_________?
(2)该混合溶液的物质的量浓度为_________?
(3)在1000g水中溶解_______摩尔NaCl才能使其浓度与上述溶液的浓度相等?
【答案】20.0% 3.93mol/L 4.27mol
【解析】
(1)根据质量分数的公式计算;
(2)先根据溶液的质量与密度的关系计算溶液的体积,再根据溶液的质量与质量分数求出溶质的质量,继而求出溶质的物质的量,根据物质的量浓度公式求出溶液的物质的量浓度;
(3)根据c=![]() 来计算物质的量浓度。
来计算物质的量浓度。
(1)20.0g质量分数为14.0%的NaCl溶液中溶质的质量m1=20.0g×14.0%=2.8g;30.0g质量分数为24.0%的NaCl溶液溶质的质量m2=30.0g×24.0%=7.2g,溶液混合前后溶质、溶液的质量都不变,所以混合液的质量分数为![]() ×100%=20%;
×100%=20%;
(2)混合溶液的密度为1.15g/cm3,NaCl的质量分数为20%,则混合后NaCl的物质的量浓度c=![]() mol/L=3.93mol/L;
mol/L=3.93mol/L;
(3)设应溶解的NaCl的物质的量为x,则有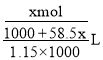 =3.92molL-1,解得:x=4.27mol。
=3.92molL-1,解得:x=4.27mol。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】某温度下,某反应达平衡时平衡常数K=c(C)·c(D)/c(A)·c(B)。恒容时,温度升高,C的物质的量浓度减小。下列说法正确的是( )
A. 该反应的焓变ΔH>0
B. 恒温恒容时,增大体系压强,c(D)一定增大
C. 升高温度,逆反应速率减小
D. 该反应的化学方程式可能为A(g)+B(g)![]() C(g)+D(g)
C(g)+D(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W在周期表中的相对位置如下图所示, 已知它们的最外层电子数之和为18,下列说法正确的是
![]()
A. X,Y,Z,W中可能都是非金属元素
B. Z的最高价氧化物的水化物一定是强酸
C. 元素的最高化合价:W>Z>Y
D. 原子半径由大到小的顺序:W>Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1mol水蒸气的能量变化示意图。写出该反应的热化学方程式________________________________。


(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
容器 | 甲 | 乙 |
容积/L | 1 | 1 |
温度/K | T1 | T2 |
起始充入量 | lmolO3 2mol NO2 | lmolO3 2mol NO2 |
①0-10min内甲容器中反应的平均速率:v(O3) =_______mol·L-1·min-1 。
②T1________T2 (填“>”“<”或“=”),T1时,该反应的平衡常数K的值为____________。
③下列措施能提高容器乙中NO2转化率的是________(填序号)。
A.向容器中充入He,增大容器的压强 B.升高容器的温度
C.向容器中再充人一定量的NO2 D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1 NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,v(正)________v(逆) (填“>”“<”“=”)。
(3)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为___________。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Na 与 H2O 的反应是熵增的放热反应,该反应能自发进行
B. 饱和 NaCl 溶液加入浓盐酸析出晶体,易溶电解质也存在溶解平衡
C. FeCl3 和 MnO2 均可加快 H2O2 分解,同等条件下二者对 H2O2 分解速率的改变相同
D. Mg(OH)2 固体在溶液中存在平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系式中,正确的是
A. 等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO- )+c(OH-)=c(H+)+c(CH3COOH)
B. 常温下,0.1 mol·L-1HA溶液与0.1 mol·L NaOH溶液等体积完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH )=c(H+)
C. 常温下,0.1 mol·L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
D. 常温下,将0.1 mol·L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中c(CHCOO-)/c(CHCOOH)的值增大到原来的100倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,Fe、HCN与K2CO3可发生反应Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O。请回答下列问题:
(1)金属铁的堆积方式为___________,其配位数为___________。
(2)HCN分子的结构式为___________,写出一种与CN-互为等电子体的阴离子:___________。
(3)键角NH3___________(填“>”“<”或“=")NF3,原因是___________。
(4)K4Fe(CN)6的中心离子的核外电子排布式为___________。
(5)C、N、O、H的第一电离能由小到大的顺序为___________。
(6)冰的晶体结构模型如图所示,其晶胞结构(如图所示)与金刚石的晶胞结构相似,水分子间以氢键相连,则一个晶胞中含有___________个氢键,用NA表示阿伏加德罗常数的值,若氢键的键长为dnm,则晶体密度ρ=___________g·cm-3(用含有d、NA的代数式表示)。
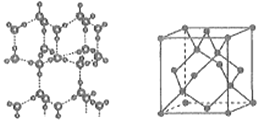
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是()
A. 制备Fe(OH)3胶体:向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液
B. 为了除去乙醇中的少量水,可向其中加入CaO,然后再蒸馏
C. 用瓷坩埚高温熔融Na2CO3固体
D. 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凯夫拉是一种高强度、耐腐蚀的芳纶纤维,军事上称为“装甲卫士”,但长期浸渍在强酸或强碱中强度有所下降。下表中是凯夫拉的两种结构:
| 芳纶1313(PMTA) | 芳纶1414(PPTA) |
结构 简式 |
|
|
以下说法不正确的是
A. PMTA和PPTA互为同分异构体
B. “芳纶1313”、“芳纶1414”中的数字表示苯环上取代基的位置
C. 凯夫拉在强酸或强碱中强度下降,可能与“![]() ”的水解有关
”的水解有关
D. 以![]() 和
和![]() 为原料制备PPTA的反应为缩聚反应
为原料制备PPTA的反应为缩聚反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com