
【题目】设阿伏伽德罗常数为6.02×1023mol﹣1 . 关于1mol H2O的叙述正确的是( )
A.含有1mol H2
B.含有6.02×1023个水分子
C.质量为18 g/mol
D.在标准状况下的体积为22.4 L
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是其内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍。
试回答下列问题:
(1)A元素的同位素有________(写原子符号)。
(2)实验室中制取B的简单氢化物的化学反应方程式为___________________________。
(3)C、D、E的简单离子半径由大到小的顺序是________(用离子符号表示);请用化学事实说明C与E这两种元素非金属性的强弱:_________________________________(举一例)。
(4)向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。请写出t2时反应的总的化学方程式___________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵明矾是一种广泛应用于医药、食品、污水处理等多个行业的重要化工产品。以高岭土(含SiO2、Al2O3、少量Fe2O3等)为原料制备硫酸铝晶体[Al2(SO4)3·18H2O]和铵明矾[NH4Al(SO4)2·12H2O]的工艺流程如下图所示。

请回答下列问题:
(1)高岭土首先需要灼烧,实验室灼烧高岭土所需的实验仪器有 (填字母)。
a.蒸发皿 b.泥三角 c.漏斗 d.酒精灯 e.三脚架 f.坩埚 g.烧杯 h.试管
(2)研究发现,随着酸熔温度升高,氧化铝的溶出率增大,但若酸熔时温度过高(超过240℃),SiO2不仅会消耗硫酸,导致氧化铝溶出率下降,还会同时产生高温的腐蚀性气体,该副反应的化学方程式为 。
(3)要检验除铁后的滤液中是否含有Fe3+,应采取的实验方法为 ;滤渣2的主要成分为 (填化学式)。
(4)“分离1”操作包含的实验步骤有 、 、 、洗涤、干燥。
(5)中和结晶操作是将过滤出硫酸铝晶体后的滤液,先用硫酸调节酸铝比(溶液中游离硫酸和硫酸铝的物质的量之比),再用氨水中和至一定的pH值即可析出铵明矾晶体,写出该过程中的总反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
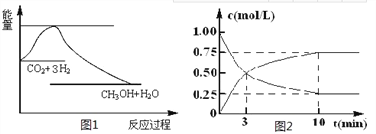
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=_________;
②下列措施中能使化学平衡向正反应方向移动的是___________(填字母)。
A.升高温度B.将CH3OH(g)及时液化抽出C.选择高效催化剂D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:_____________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极的电极反应式是:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:
![]()
试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为 ;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 、玻璃棒和烧杯等;步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是 ;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 ;
(5)步骤Ⅵ中发生反应的化学反应方程式为 ;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol·L-1。试判断所得的FeCO3中是否含有Fe(OH)2 (填“是”或“否”),请通过简单计算说明理由。(已知:Ksp[Fe(OH)2]=4.9×10-17) ;
(7)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①原子中处于第3能层的电子跃迁到第2能层时需要放出能量;②M能层可以有s、p、d、f能级;
③3p正表示有3个p正轨道;④在一个原子中,不可能出现运动状态完全相同的两个电子;⑤2s电子云有两个空间取向。
A. ①②③ B. ①④ C. ②⑤ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g) △H=+56.76kJ/mol,自发进行的原因( )
A. 是吸热反应 B. 是放热反应
C. 是熵减少的反应 D. 熵增大效应大于焓增大的效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com