


| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
分析 钛铁矿用氢氧化钠溶液溶解,氧化铝、二氧化硅反应溶解,过滤得到钛铁矿精矿中主要含有FeTiO3、FeO,再用浓硫酸处理,得到强酸性溶液中含有TiOSO4、FeSO4及未反应的硫酸等,由图1可知TiO(OH)2与Fe(OH)3沉淀的pH很接近,所以加入铁粉目的是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀,沉降分离得到溶液中主要含有Fe2+、TiO2+及硫酸根,再浓缩蒸发得到绿矾与溶液Ⅱ,溶液Ⅱ中含有TiOSO4,加入碳酸钠溶液,调节pH接近3,TiO(OH)2沉淀完全,再经过系列操作得到Ti.
(1)步骤I中发生反应有:氧化铝与氢氧化钠反应生成偏铝酸钠与水,二氧化硅与氢氧化钠反应生成硅酸钠与水;
(2)①步骤Ⅲ加入铁屑,将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;
②TiO2+易水解,只能存在于强酸性溶液中,所以TiO2+水解生成TiO(OH)2与H+;
加入碳酸钠溶液,促进TiO2+水解,调节pH接近3,TiO(OH)2沉淀完全;
(3)控制稳定使混合物中Mg、MgCl2转化为气态,而Ti不能转化为气态;
(4)电解时阳极发生氧化反应,由电解池结构可知,阳极上氧离子失去电子生成氧气,与碳作用生成二氧化碳.
解答 解:钛铁矿用氢氧化钠溶液溶解,氧化铝、二氧化硅反应溶解,过滤得到钛铁矿精矿中主要含有FeTiO3、FeO,再用浓硫酸处理,得到强酸性溶液中含有TiOSO4、FeSO4及未反应的硫酸等,由图1可知TiO(OH)2与Fe(OH)3沉淀的pH很接近,所以加入铁粉目的是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀,沉降分离得到溶液中主要含有Fe2+、TiO2+及硫酸根,再浓缩蒸发得到绿矾与溶液Ⅱ,溶液Ⅱ中含有TiOSO4,加入碳酸钠溶液,调节pH接近3,TiO(OH)2沉淀完全,再经过系列操作得到Ti.
(1)步骤I中发生反应有:氧化铝与氢氧化钠反应生成偏铝酸钠与水,二氧化硅与氢氧化钠反应生成硅酸钠与水,相应反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O;
(2)①由图可知TiO(OH)2与Fe(OH)3沉淀的pH很接近,所以加入铁粉目的是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀,
故答案为:将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;
②TiO2+易水解,只能存在于强酸性溶液中,所以TiO2+水解生成TiO(OH)2与H+,离子方程式为:TiO2++2H2O?TiO(OH)2+2H+;
加入碳酸钠溶液后得到TiO(OH)2沉淀,所以向溶液Ⅱ中加入Na2CO3粉末的作用是:调节溶液pH值,促进TiO2+水解;由图可知,pH=3时TiO(OH)2已沉淀完全,
故答案为:TiO2++2H2O?TiO(OH)2+2H+;调节溶液pH值,促进TiO2+水解; 3;
(3)Mg、MgCl2的沸点最高是1412℃,而Ti的熔点为1667℃,所以当温度略高于1412℃时Mg、MgCl2以气体的形式除去,而得到Ti,
故答案为:1412;
(4)电解时阳极发生氧化反应,由电解池结构可知,阳极上氧离子失去电子生成氧气,与碳作用生成二氧化碳,阳极电极反应式为:C+2O2--4e-=CO2↑,
故答案为:C+2O2--4e-=CO2↑.
点评 本题综合考查物质制备实验、物质分离提纯、对操作的分析评价、电解原理等,注意分析工艺流程中试剂线、原理线、操作线,要求学生具有一定分析和解决问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 可溶性盐的水溶液一定呈中性 | |
| B. | 离子化合物中一定含有金属元素 | |
| C. | 氧化还原反应中一定有元素化合价的升降 | |
| D. | 强电解质溶液的导电性一定强于弱电解质溶液的导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
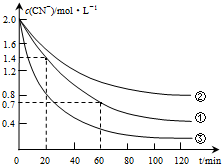 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2 | B. | CH3CH═CHCH3 | C. | CH3CH═CH2 | D. | CH2═CHCH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
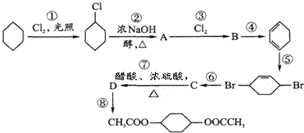 从环己烷可制备1,4-环己二醇二醋酸酯,下列过程是有关的8步反应(其中所有无机产物都已略去):
从环己烷可制备1,4-环己二醇二醋酸酯,下列过程是有关的8步反应(其中所有无机产物都已略去):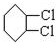 ,C
,C ,D
,D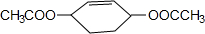 .
.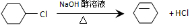 ;
;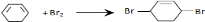 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的化合价的周期性变化 | |
| B. | 元素原子的原子半径的周期性变化 | |
| C. | 元素原子的核外电子排布的周期性变化 | |
| D. | 元素原子的电子层数的周期性变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com