


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-=3I2+2NO↑+4H2O |
| C、用硫酸酸化的淀粉碘化钾溶液在空气中变蓝:4I-+O2+4H+=2I2+2H2O |
| D、向NH4Al(SO4)2溶液中滴加Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:

 中的配位键.
中的配位键.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一个体积为1L的密闭容器中发生某化学反应:2A(g)?B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol?L-1)随时间(min)的变化如图所示.试回答下列问题:
在一个体积为1L的密闭容器中发生某化学反应:2A(g)?B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol?L-1)随时间(min)的变化如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
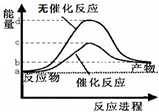
| A、根据如图知该反应有催化剂和无催化剂的活化能相差d-c,但其反应热均为a-b | ||
| B、若2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5kJ/mol | ||
| C、需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | ||
| D、已知:Ⅰ:对于反应:3Si(s)+2N2(g)=Si3N4(s)△H=-a kJ/mol,Ⅱ:N≡N键能为bkJ?mol-1Si-Si键能为ckJ?mol-1 且a、b、c均大于零,则断开1 mol Si-N键所需的能量为
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com