
����Ŀ��A��B��C��D��E������������ͼ��ʾ��ת����ϵ��������A��һ�ֵ���ɫ�Ĺ��塣
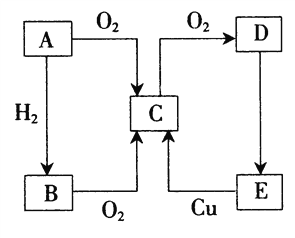
(1)д��B��D�������ʵĻ�ѧʽ��B________��D________��
(2)�ٸո��Ƴɵ�ʪ��˿���������ڷ�����C��Ѭ�ƣ�����������C��________���á�
��ʵ�����п���________(���Լ�)������C�Ĵ��ڣ����õ���C��________�ԡ�
(3)Ũ��E��Һ�ڳ�����Ϊ����Һ�壬��E��Һ����ǿ��ˮ�ԡ�ǿ��ˮ�ԡ�ǿ�����ԡ���
�ٽ�E��Һ���ڷ����ڿ����У�������������_______����������E������_______�ԡ�
��E��Һ������ˮ��ʱ��������������������ʿ���E��Һ�������________��
A��������������������B������(����ǿ��ԭ��)
C��������������������D����������
E��������������������F���⻯��(����ǿ��ԭ��)
G���廯��(����ǿ��ԭ��)
����պ��ŨE��Һ�IJ�������ľ����д�֣��ּ�һ����ͱ�ڣ�˵��ŨE��Һ����________�ԡ�
��ŨE��Һ����ǿ������ʱ���ڼ��ȵ�����������ͭ��̼���ʵȷ�Ӧ����ʵ��E��C��ת������д��E�ֱ���ͭ��̼���ʷ�Ӧ�Ļ�ѧ����ʽ��__________________________________________����ָ��E��ͭ��Ӧʱ�����˱���ǿ�������⣬������ʲô����______________��
��ϡ��E��Һ��������ϴ�ӽ��������ͭ������⣬��д���йصĻ�ѧ����ʽ��______________��
���𰸡� H2S�� SO3 Ư�ס�ɱ������ Ʒ����Һ Ư�� ��С ��ˮ�� CDE ��ˮ 2H2SO4(Ũ)��Cu![]() CuSO4��SO2����2H2O,2H2SO4(Ũ)��C
CuSO4��SO2����2H2O,2H2SO4(Ũ)��C![]() CO2����2SO2����2H2O ���� 3H2SO4��Fe2O3===Fe2(SO4)3��3H2O,2H2SO4��Cu2(OH)2CO3===2CuSO4��CO2����3H2O
CO2����2SO2����2H2O ���� 3H2SO4��Fe2O3===Fe2(SO4)3��3H2O,2H2SO4��Cu2(OH)2CO3===2CuSO4��CO2����3H2O
��������A��B��C��D��E��������������A��һ�ֵ���ɫ�Ĺ��嵥����C�����ܹ�ʹƷ����Һ��ɫ,���ת����ϵ����֪����AΪS��CΪ![]() ��BΪ
��BΪ![]() ��DΪ
��DΪ![]() ��EΪ
��EΪ![]() ��
��
(1)����������B��D�������ʵĻ�ѧʽ�ֱ�Ϊ��H2S��SO3 ����ȷ�𰸣� H2S��SO3��
(2)�ٸո��Ƴɵ�ʪ��˿���������ڷ�����SO2��Ѭ�ƣ�����������SO2��Ư����ɱ���������ã���ȷ�𰸣�Ư�ס�ɱ��������
��ʵ�����п���Ʒ��������SO2�Ĵ��������õ���SO2��Ư��������ȷ����Ʒ����Һ �� Ư�ס�
(3) ����![]() ��Һ���ڷ����ڿ�������Ũ���������ˮ�����������������������������С����������Ũ�����������ˮ�ԣ���ȷ�𰸣���С����ˮ�ԡ�
��Һ���ڷ����ڿ�������Ũ���������ˮ�����������������������������С����������Ũ�����������ˮ�ԣ���ȷ�𰸣���С����ˮ�ԡ�
��Ũ���������ˮ��ʱ�������������Ũ�������백����Ӧ��Ũ�������ǿ���������������������⻯����廯�⣻Ũ������������Ӧ����������Ũ��������������CDE����ȷѡ��CDE��
����պ��Ũ����IJ�������ľ����д�֣��ּ�һ����ͱ�ڣ�˵��Ũ���������ˮ�ԣ���ȷ�𰸣���ˮ��
��Ũ�������ǿ������ʱ���ڼ��ȵ�����������ͭ��Ӧ��������ͭ�����������ˮ����Ӧ�Ļ�ѧ����ʽ��2H2SO4(Ũ)��Cu![]() CuSO4��SO2����2H2O�������ں�ͭ���ȷ�Ӧʱ��һ����Ũ���ᱻ��ԭΪ���������в���Ũ������������ͭ������Ϊ���ԣ��ڼ��ȵ�����������̼��Ӧ���ɶ�����̼�����������ˮ����Ӧ�Ļ�ѧ����ʽ��2H2SO4(Ũ)��C
CuSO4��SO2����2H2O�������ں�ͭ���ȷ�Ӧʱ��һ����Ũ���ᱻ��ԭΪ���������в���Ũ������������ͭ������Ϊ���ԣ��ڼ��ȵ�����������̼��Ӧ���ɶ�����̼�����������ˮ����Ӧ�Ļ�ѧ����ʽ��2H2SO4(Ũ)��C![]() CO2����2SO2����2H2O����ȷ����2H2SO4(Ũ)��Cu
CO2����2SO2����2H2O����ȷ����2H2SO4(Ũ)��Cu![]() CuSO4��SO2����2H2O��2H2SO4(Ũ)��C
CuSO4��SO2����2H2O��2H2SO4(Ũ)��C![]() CO2����2SO2����2H2O�����ԡ�
CO2����2SO2����2H2O�����ԡ�
��ϡ���᳣����ϴ�ӽ��������ͭ������⣬��������������ԣ������ܹ�����������Ӧ������������ˮ����Ӧ����ʽΪ3H2SO4��Fe2O3===Fe2(SO4)3��3H2O�������ܹ����ʽ̼��ͭ��Ӧ��������ͭ��������̼��ˮ����Ӧ����ʽΪ2H2SO4��Cu2(OH)2CO3===2CuSO4��CO2����3H2O����ȷ����3H2SO4��Fe2O3===Fe2(SO4)3��32O��2H2SO4��Cu2(OH)2CO3===2CuSO4��CO2����3H2O��


 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼������ء���һ��������Դװ�ã��乤��ԭ������ͼ������˵����ȷ����

A. ��װ���ǽ�����ת��Ϊ��ѧ��
B. �����ĵ缫��ӦΪ��C2O42--2e-=2CO2
C. ÿ�õ�1 mol����������·��ת��3 mol����
D. ���øü����ɲ������е�CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
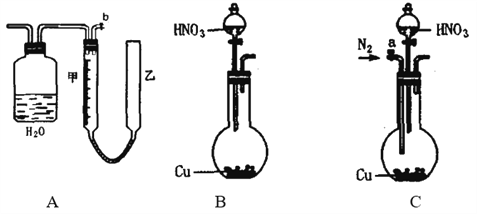
����Ŀ����������ͼ�е�ʵ��װ�òⶨ����ͭ������һ��Ũ�ȵ�Ũ���ᷴӦ����NO��NO2�����ʵ���֮�ȣ���m��ʾ��������װ��C�ɹ��ƿ����������ɣ��������ɼס���������������ɣ�����Ƥ����ͨ����װ������ˮ�����п̶ȣ�0mL��50mL�����ҹܿ������ƶ���
��ش��������⣺
��1��ʵ�������壨NO��NO2������װ��Ӧѡ��___________����װ����ţ���
��2��ʵ�������壨NO��NO2��ͨ��Cװ�ã�������ͼ�Ĺ��ƿ�н������ܻ���______��
��3�����Ӻ�װ�ã���������Ժ�Ӧ���еIJ�����
��һ����b����Cװ�õ��ҹ��м�����ˮ��
�ڶ���_________________________________________________________________________��
����������Һ©�����ϵIJ��������ٽ���Һ©������Ļ���š��������ƿ�м���Ũ���ᣬ��ͭ��Ӧ��
��4��ʵ��ǰ�ס�������Һ����ͬһˮƽ���ϣ�������ʱ�ҹܵ�Һ����ڼܵ�Һ�档��ʱӦ���ҹ�_______�������������������������ƶ���ʹ________________________��
��5��ʵ������������������������ѻ���ɱ�״����ΪV��L����C����������ʵ���Ϊn mol�����ú�n��V��ʽ�ӱ�ʾm��____________________________������ɲ��ػ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������ܴ���������ͬһ��Һ�е��ǣ�������
A.Fe2+ H+ NO3�� SO42��
B.Fe3+ NH4+ Cl�� I��
C.Cu2+ Mg2+ NO3�� Cl��
D.Al3+ Na+ SO42�� OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������пΪ��ɫ��ĩ��������ʪ�Ѣ��Ƥ���������ơ�������ҵ������п������Fe��������Mn��II����Ni��II�������ʣ����������£�
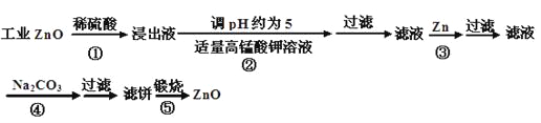
��ʾ���ڱ�ʵ�������£�Ni��II�����ܱ�������������صĻ�ԭ������MnO2���ش��������⣺
��1����Ӧ���г���������������____________��д�����з�����һ����Ӧ�����ӷ���ʽΪ___________________________________________________________________________�� ����
�ڼӸ��������Һǰ����pH�ϵͣ��Գ��ӵ�Ӱ����______________________________________
��2����Ӧ�۵ķ�Ӧ����Ϊ_______________���˵õ��������У����˹�����п���_____________
��3����Ӧ���γɵij���Ҫ��ˮϴ��������ϴ�Ӹɾ��ķ�����_____________________________
��4����Ӧ���в���ijɷֿ�����ZnCO3��xZn(OH)2��ȡ�������˱�11.2g�����պ�ɵõ���Ʒ8.1g����x����_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���������п��ܺ��У� K+�� Na+��Cl����CO32����SO42�������ӣ����ù����ܽ����õ�����Һ��������ʵ�飺
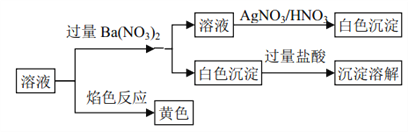
����˵����ȷ����
A. �û����һ����K2CO3�� NaCl B. �û��������� Na2CO3�� KCl
C. �û����һ����Na2CO3�� NaCl D. �û��������� Na2SO4�� Na2CO3
���𰸡�B
����������ɫ��Ӧ�ʻ�ɫ��˵��һ������Na+������������ᱵ��������������ij�����ԭ��Һһ������CO32����һ������SO42��������������ᱵ�����Һ�м��������ữ�������������ɰ�ɫ��������ԭ��Һһ������Cl�����������Ϸ�����һ������Na+��Cl����CO32����һ������SO42�������ܺ���K+�����Ըû��������� Na2CO3�� KCl��K2CO3��NaCl����B��ȷ��
�����͡���ѡ��
��������
20
����Ŀ��һ�������ƺ����Ļ������������ˮ��ַ�Ӧ��û�н���ʣ�࣬�յ�2.24L���壬����˵��һ����ȷ����
A. ��������Ϊ���� B. ������������ʵ���Ϊ 0.1 mol
C. ��������ֻ����һ����ѧ��Ӧ D. ������Һ��ֻ��һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������H2������������
���� | ����Һ | �¶� | |
A | Mg | 0.5molL-1H2SO4 | 20�� |
B | Fe | 1 molL-1HCl | 20�� |
C | Zn | 2 molL-1HCl | 20�� |
D | Mg | 1 molL-1H2SO4 | 30�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д����ȷ����( )
A. Cu�ڼ���ʱ���ڹ���Ũ���Cu��4H����![]()
![]() Cu2����SO2����2H2O
Cu2����SO2����2H2O
B. Na2O2��H2O��Ӧ�Ʊ�O2��2Na2O2��2H2O=4Na����4OH����O2��
C. ��Mg��HCO3��2��Һ�м������NaOH��Һ��Mg2����4OH����2![]() =Mg��OH��2����2H2O��2
=Mg��OH��2����2H2O��2![]()
D. ��FeI2��Һ�м��������ˮ��2Fe2����4I����3Br2��2Fe3����2I2��6Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ճ������г��õ����ӵ�ʳ�Ρ����������ࡱ����Ʒ������ĵ�ͷ�Ӧ����Ϊ��������
A.����
B.����
C.Ԫ��
D.������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com