
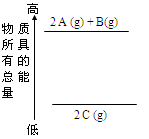
| A.2 A(g)+ B(g) = 2 C(g);△H<0 |
| B.2 A(g)+ B(g) = 2 C(g);△H>0 |
| C.2A + B = 2 C;△H<0 |
| D.2C =2 A +B ;△H<0 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
| | Na2S2O3·5H2O | CaCl2·6H2O | Na2SO4·10H2O | Na2HPO4·12H2O |
| 熔点(℃) | 40.50 | 29.92 | 32.38 | 35.1 |
| 熔化热(kJ/mol) | 49.7 | 37.3 | 77 | 100.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.甲烧瓶中气体颜色变浅 |
| B.乙烧瓶中气体颜色变深 |
| C.丙烧瓶中气体压强明显增大 |
| D.上述三种说法都不正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
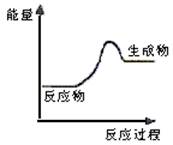
| A.该反应为吸热反应 |
| B.该反应一定有能量转化成了化学能 |
| C.反应物比生成物稳定 |
| D.因为生成物的总能量高于反应物的总能量,所以该反应不需要加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
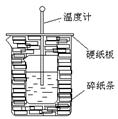
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③④⑤ | B.①⑥⑦ | C.②③④ | D.①③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 反应装置或图像 | 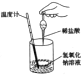 | 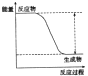 | 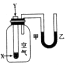 | 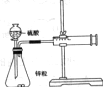 |
| 实验现象或图像信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.放热反应在常温下不一定很容易发生 |
| B.需要加热方能发生的反应一定是吸热反应 |
| C.反应是放热还是吸热须看反应物和生成物具有的总能量的相对大小 |
| D.吸热反应在一定条件下也能发生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.乙炔的燃烧热为1256 kJ·mol-1 |
| B.若转移10 mol电子,则消耗2.5 mol O2 |
| C.若生成2 mol液态水,则ΔH=-2512 kJ·mol-1 |
| D.若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com