
| A. | 全部 | B. | ①②⑤ | C. | ② | D. | ②③ |
分析 一般来说,增大浓度、温度、压强、加入催化剂,增大固体表面积等,可增大反应速率,以此解答该题.
解答 解:①如果反应物是固体,增加固体反应物的物质的量,反应速率不变,故①错误;
②由于温度升高,增大活化分子百分数,反应速率一定加快,故②正确;
③如通入惰性气体,增大压强,但反应物浓度不变,反应速率不变,故③错误;
④不断分离出生成物可导致生成物浓度降低,反应速率减小,故④错误;
⑤MnO2不为所有反应的催化剂有加快反应速率的,反应速率不一定加快,故⑤错误;
故选C.
点评 本题考查影响化学反应速率的常见因素,较简单,为高频考点,侧重于学生的分析能力的考查,反应中固体、纯液体的量发生改变对反应速率无影响是学生在解题中容易忽略的知识.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol任何物质都含有6.02×1023个原子 | |
| B. | 标准状况下,22.4L NH3的物质的量为1mol | |
| C. | 硫酸的摩尔质量是98 g | |
| D. | 常温常压下,1 mol氧气的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10 O (醇类) | B. | C3H6Cl(不饱和卤代烃) | ||
| C. | C4H8O2(酯类) | D. | C9H12(芳香烃) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆原理相似 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO${\;}_{3}^{2-}$+2HClO | |
| D. | 等体积、等物质的量浓度AlCl3与NaOH溶液混合:Al3++4OH-═AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
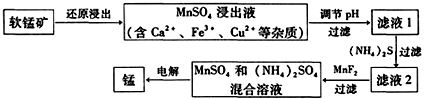
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO)•c(S{O}_{3})}{c(N{O}_{2})•c(S{O}_{2})}$的值及SO2转化率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com