
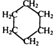
 可用键线式表示为
可用键线式表示为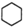 ,
,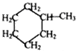 可用键线式表示为
可用键线式表示为 ;
;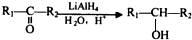 ;
;
 ;
; ;
; 结构
结构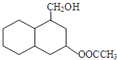 .
.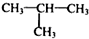 制
制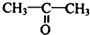 的流程图并注明反应条件.
的流程图并注明反应条件. 分析 A发生氧化反应生成B,醛基被氧化生成羧基,B发生酯化反应或取代反应生成C,C发生消去反应生成D,根据DF分子式知,D发生加成反应生成F,F结构简式为 ;
;
(5)2-甲基丙烷和氯气在光照条件下发生取代反应生成2-甲基-2-氯丙烷,2-甲基-2-氯丙烷发生取代反应生成2-甲基-2-丙醇,2-甲基-2-丙醇发生消去反应生成2-甲基丙烯,2-甲基丙烯发生氧化反应生成丙酮.
解答 解:A发生氧化反应生成B,醛基被氧化生成羧基,B发生酯化反应或取代反应生成C,C发生消去反应生成D,根据DF分子式知,D发生加成反应生成F,F结构简式为 ;
;
(1)根据图中结构简式知,A发生氧化反应生成B,故答案为:氧化反应;
(2)通过以上分析知,F结构简式为 ,故答案为:
,故答案为: ;
;
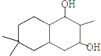
(3)B发生酯化反应或取代反应生成C,反应方程式为 ,故答案为:
,故答案为: ;
;
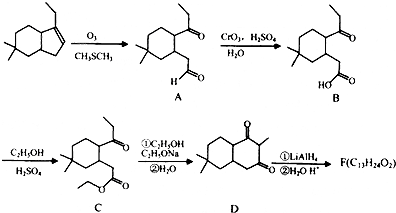
(4)B的同分异构体符合下列条件:Ⅰ含 结构,Ⅱ属于酯类化合物,说明含有酯基;
结构,Ⅱ属于酯类化合物,说明含有酯基;
Ⅲ不能发生银镜反应,说明不含醛基,
如果含有CH3COO-和 ,有10种结构;
,有10种结构;
如果含有-COOCH3和 ,有10种结构;
,有10种结构;
所以符合条件的有20种;其中一种同分异构体结构简式为 ,
,
故答案为:20; ;
;
(5)2-甲基丙烷和氯气在光照条件下发生取代反应生成2-甲基-2-氯丙烷,2-甲基-2-氯丙烷发生取代反应生成2-甲基-2-丙醇,2-甲基-2-丙醇发生消去反应生成2-甲基丙烯,2-甲基丙烯发生氧化反应生成丙酮,其流程图为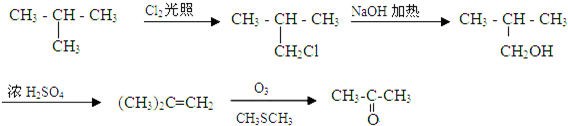
,故答案为: .
.
点评 本题考查有机物推断和合成,为高频考点,侧重考查学生分析推断及知识综合应用能力,明确常见有机物官能团及其性质是解本题关键,知道常见反应类型及反应条件,难点是合成路线设计和同分异构体种类判断,注意 中环上有10种氢原子,为易错点.
中环上有10种氢原子,为易错点.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2中存在非极性键 | |
| B. | Na2O2属于电解质,而Cl2、SO2均属于非电解质 | |
| C. | Na2O2与SO2反应和Na2O2与CO2反应完全相同 | |
| D. | 将等物质的量Cl2和SO2同时通入品红溶液,溶液褪色更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型 可以表示CO2分子或SiO2分子 可以表示CO2分子或SiO2分子 | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | HCO3-的电离方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | 含18个中子的氯原子的核素符号:${\;}_{35}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 蒸馏时应先向冷凝管中通入冷凝水再加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 纯净物 | 纯硫酸 | 冰醋酸 | 水玻璃 | 胆矾 |
| 混合物 | 水煤气 | 福尔马林 | 冰水混合物 | 漂白粉 |
| 弱电解质 | 氨水 | 氟化氢 | 氨 | 水 |
| 非电解质 | 干冰 | 乙醇 | 三氧化硫 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3NA | |
| B. | 3.4g NH3中含原子总数目为0.6NA | |
| C. | 新制的含NA个Fe(OH)3分子的氢氧化铁胶体中,含有胶粒的物质的量为1mol | |
| D. | 23gNO2和N2O4的混合气体中含有原子总数1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com