
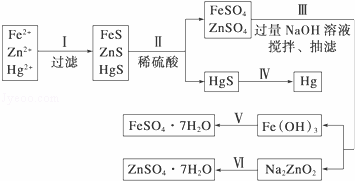
某工厂排出的污水中含有大量的Fe3+、Zn2+、Hg2+三种金属离子.以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4•7H2O)和汞的方案.
NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
如图
(1)步骤Ⅱ所发生反应的离子方程 .
步骤Ⅲ中抽滤的目的是 ,该步骤产生Fe(OH)3的反应的离子方程式为 .
(3)步骤Ⅵ中得到硫酸锌溶液的离子方程式为 .
(4)欲实现步骤Ⅴ,需加入的试剂有 、 ,所涉及的主要操作依次为 .
(5)步骤Ⅳ常用的方法是 ,该步骤是否对环境有影响? (填“是”或“否”),如有影响,请你设计一个绿色环保方案来实现步骤Ⅳ的反应: .
(6)该研究小组的同学在强碱溶液中,用次氯酸钠与Fe(OH)3反应获得了高效净水剂Na2FeO4,该反应的离子方程式为 .
考点: 物质分离和提纯的方法和基本操作综合应用;常见离子的检验方法.
专题: 实验设计题.
分析: (1)步骤Ⅱ中只有FeS、ZnS固体溶解在稀硫酸中生成FeSO4、ZnSO4;
抽滤时产生负压,能加快过滤;向FeSO4和ZnSO4的混合溶液中加入过量NaOH时,Fe2+与OH﹣反应生成Fe(OH)2,Fe(OH)2迅速被空气中的O2氧化为Fe(OH)3;
(3)根据框图转化关系,不难发现Zn(OH)2的性质类似于Al(OH)3的,Na2ZnO2的性质类似于NaAlO2的,所以向Na2ZnO2的溶液中加入过量H2SO4生成ZnSO4溶液;
(4)Fe(OH)3首先与稀H2SO4反应生成Fe2(SO4)3,Fe2(SO4)3再与过量的Fe粉反应得到FeSO4;
(5)HgS在空气中加热可得Hg、SO2,由于Hg蒸气和SO2都会对环境造成污染,在密闭容器中加热HgS可有效防止Hg蒸气和SO2释放到大气中;
(6)反应物有ClO﹣、Fe(OH)3、OH﹣,生成物有Cl﹣、FeO42﹣、H2O,则有ClO﹣+Fe(OH)3+OH﹣﹣→FeO42﹣+Cl﹣+H2O,再将该离子方程式配平即可.
解答: 解:(1)步骤Ⅱ中只有FeS和ZnS固体,FeS固体溶解在稀硫酸中生成FeSO4,反应方程式为FeS+2H+═Fe2++H2S↑,ZnS固体溶解在稀硫酸中生成ZnSO4,反应方程式为ZnS+2H+═Zn2++H2S↑,
故答案为:FeS+2H+═Fe2++H2S↑、ZnS+2H+═Zn2++H2S↑;
抽滤时产生负压,能加快过滤;向FeSO4和ZnSO4的混合溶液中加入过量NaOH时,Fe2+与OH﹣反应生成Fe(OH)2,Fe(OH)2迅速被空气中的O2氧化为Fe(OH)3,其反应的离子方程式为4Fe2++O2+8OH﹣+2H2O═4Fe(OH)3↓;
故答案为:加快过滤;4Fe2+O2+8OH﹣+2H2O═4Fe(OH)3↓;
(3)根据框图转化关系,不难发现Zn(OH)2的性质类似于Al(OH)3的,Na2ZnO2的性质类似于NaAlO2的,所以向Na2ZnO2的溶液中加入过量H2SO4生成ZnSO4溶液,其反应的离子方程式为ZnO22﹣+4H+═Zn2++2H2O,
故答案为:ZnO22﹣+4H+═Zn2++2H2O;
(4)Fe(OH)3首先与稀H2SO4反应生成Fe2(SO4)3,Fe2(SO4)3再与过量的Fe粉反应得到FeSO4.经过滤除去Fe粉,将滤液经过浓缩结晶可得FeSO4•7H2O,
故答案为:稀硫酸;铁粉(过量);过滤、浓缩结晶;
(5)HgS在空气中加热可得Hg、SO2,由于Hg蒸气和SO2都会对环境造成污染,在密闭容器中加热HgS可有效防止Hg蒸气和SO2释放到大气中,从而保护了环境,
故答案为:加热;是;在密闭容器中加热HgS;
(6)反应物有ClO﹣、Fe(OH)3、OH﹣,生成物有Cl﹣、FeO42﹣、H2O,则有ClO﹣+Fe(OH)3+OH→FeO42﹣+Cl﹣+H2O,配平该离子方程式为3ClO﹣+2Fe(OH)3+4OH﹣═2FeO42﹣+3Cl﹣+5H2O.
故答案为:3ClO﹣+2Fe(OH)3+4OH﹣═2FeO42﹣+3Cl﹣+5H2O.
点评: 本题是一道关于元素和化合物知识综合考查题,考查学生分析问题能力和解决问题的能力,综合性强,难度大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为()
A. 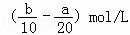 B. (2b﹣a)mol/L C.
B. (2b﹣a)mol/L C. 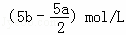 D. (10b﹣5a)mol/L
D. (10b﹣5a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
A. MnO2 与浓盐酸反应制Cl2:MnO2+4HCl Mn2++2Cl﹣+Cl2↑+2H2O
Mn2++2Cl﹣+Cl2↑+2H2O
B. 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+
C. Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH﹣+O2↑
D. Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3﹣+Ca2++OH﹣═CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.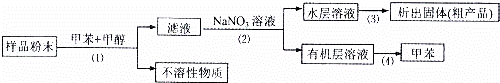
下列说法错误的是( )
A. 步骤(1)需要过滤装置 B. 步骤需要用到分液漏斗
C. 步骤(3)需要用到坩埚 D. 步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )
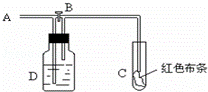
A. D中不可能是浓硫酸 B. 通入的氯气含有水蒸气
C. D中不可能是NaOH溶液 D. D中可以是饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 阿伏加德罗常数为6.02×1023
B. 摩尔质量等于该粒子的相对原子质量或相对分子质量
C. 1molH2的体积为22.4L
D. Na+的摩尔质量为23g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.离子晶体中可能含有共价键,但不一定含有金属元素
B.分子晶体中一定含有共价键
C.非极性分子中一定存在非极性键
D.对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔、沸点越高
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
|
| A. | A、B、C、D、E | B. | E、C、D、B、A | C. | B、A、D、C、E | D. | C、D、A、B、E |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com