
科目:高中化学 来源: 题型:
下列反应属于氧化还原 反应,但水既没有做氧化剂又没有做还原剂的是
反应,但水既没有做氧化剂又没有做还原剂的是
A.2F2+2H2O =4HF +O2 B.3NO2+H2O =2HNO3+NO
=2HNO3+NO
C.2Na +2H2O=2NaOH+H2 D.CaO+H2O =Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:①5Fe2++ MnO +8H+=5Fe3+ +Mn2++4H2O
+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO +16H+=10CO2↑+2Mn2++8H2O
+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 ▲ 。
(2)滤液经处理可得到副产品 ▲ 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 ▲ 。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如右图,其变化趋势的原因可能为 ▲ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构
 如右图所示,下列说法正确的是
如右图所示,下列说法正确的是
A. 该有机物的分子式为C7H7O3
B.该有机物能发生取代、加成和氧化反应
C.1 mol该有机物最多能与2 molH2发生加成反应
D.该有机物的一种芳香族同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是
A.浓硝酸应保存在棕色试剂瓶中 B.工业上利用合成氨实现人工固氮
C.带磨口玻璃塞的试剂瓶保存烧碱溶液 D.常温下用钢瓶贮存浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是
A.过氧化钠投入水中: 2Na2O2 + 2H2O=4Na+ + 4OH-+ O2↑
B.二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O
C.碳酸钙溶于盐酸 CO32- + 2H+=H2O + CO2↑
D.向氯化亚铁溶液中滴入氯水: Fe2+ + Cl2=Fe3++ 2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
乙烯是重要化工原料,其产量是一个国家石油化工水平的标志。通过石油裂解可以获得乙烯,再以乙烯为原料还可以合成很多的化工产品。已知乙烯能发生以下转化:
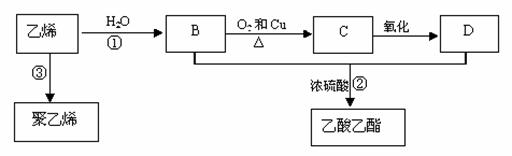
(1)乙烯的结构简式为 。
(2)反应①的反应类型是 ,D中含官能团名称为 。
(3)写出以下反应的化学方程式:
① ;
② ;
③ 。
(4)乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
工艺一:
工艺二: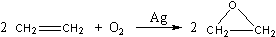
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,在实际生产中,应采用
(填“工艺一”或“工艺二”)更环保、更经济。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列数量的各物质所含原子数(包括离子)由小到大顺序排列的是
①0.5molNH3 ②22.4L氦气(标况下) ③9mL液态水 ④0.2molNa3PO4
A.②③④① B.④②③① C.①④③② D.①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
某城市某河道两旁有甲乙两厂,它们排放的工业废水中共含有K+、Ag+、Fe3+、CL-、OH-、NO3-六种离子。
⑴甲厂的废水明显呈碱性,故甲厂废水中含有的三种离子是 、 、 ;



 ⑵乙厂的废水中含有另外的三种离子。如果加入一定量的 (填“活性炭”、“硫酸亚铁”、“铁粉”),可以回收其中的金属是 ,因为 (用离子方程式表示)
⑵乙厂的废水中含有另外的三种离子。如果加入一定量的 (填“活性炭”、“硫酸亚铁”、“铁粉”),可以回收其中的金属是 ,因为 (用离子方程式表示)


 ⑶有人提出一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填离子符号)转化为沉淀,经过滤后的废水中主要含有 ,
⑶有人提出一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填离子符号)转化为沉淀,经过滤后的废水中主要含有 ,
(填离子符号)所以可用来浇灌农田。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com