
����Ŀ�����������н�50mL��0.50molL��1CH3COOH��Һ��50mL��0.55molL��1NaOH��Һ��ϣ��¶ȴ�25.16�����ߵ�27.46�森��֪���ȼƵ����ݳ��������ȼƸ�����ÿ����10C�������������150J0C��1 �� C=4.18Jg��10C��1 �� ��Һ���ܶ�Ϊ1gcm��3 �� 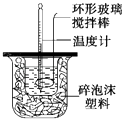
��1������CH3COOH�ġ��к��ȡ���
��2�����������1���в�õ�ʵ��ֵƫ�������ʲôԭ����ɵģ� ��
��3����HNO3 ��aq��+NaOH��aq��=NaNO3��aq��+H2O��l������H=��57.3KJmol��1��
���Т�ϡH2SO4��Ba��OH��2��aq�� ��ŨH2SO4��Ba��OH��2��aq��
��HNO3��Ba��OH��2��aq����Ӧ����1molH2O��l�� �ķ�Ӧ�ȷֱ�Ϊ��H1����H2����H3 ��
���H1����H2����H3������С����Ĺ�ϵΪ�� ��
���𰸡�
��1���⣺�¶Ȳ��t=27.46�橁25.16��=2.3�棬Q=cm��t=2.3���4.18J/��g�棩��100g+150J0C��1��2.3��=1306.4J=1.31kJ����H= ![]() =
= ![]() =��52.4kJ/mol��
=��52.4kJ/mol��
��CH3COOH���к��ȡ�H=��53.3 kJ/mol
��2�������ȼƵı���ƿЧ�����ã����������Ҫ����
��3����H2����H1����H3
���������⣺��2����1���в�õ�ʵ��ֵƫ�ͣ�����ԭ���У������ȼƵı���ƿЧ�����ã����������Ҫ���ȣ�
���Դ��ǣ������ȼƵı���ƿЧ�����ã����������Ҫ���ȣ���3��HNO3��KOHΪǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦ��H+��aq��ʮOH����aq��=H2O��H3=��57.3kJ/mol��ϡH2SO4��Ba��OH��2��aq���γɳ������ų��������ų�����������57.3kJ�����H1����57.3kJ/mol��Ũ��������ˮʱ�ų�����������������Զ����57.3kJ����H2����57.3kJ/mol�����ԡ�H2����H1����H3��
���Դ��ǣ���H2����H1����H3 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ӽ���ķ�����ȷ���ǣ� ��
A.ij��Һ�еμ�AgNO3��Һ�а�ɫ������˵��ԭ��Һ����Cl��
B.ij��Һ���ȵμ����������������ٵμ�BaCl2��Һ�а�ɫ��������ԭ��Һ����SO42��
C.ij��ɫ��Һ�����̪��Һ�Ժ�ɫ������Һһ���Ǻ��д�����H+
D.ij��Һ�еμ�ϡ����������ɫ���壬˵��ԭ��Һ����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������A��B��C��D������ͼת����ϵ�� 
��1����D���ȼҵ����Ҫ��Ʒ��B���������������Ӧ�ڵ����ӷ���ʽ�ǣ�
��2����A��һ�ּ������壬�������������B������β��֮һ�����������ɫ����Ӧ�ٵĻ�ѧ����ʽΪ
��3����AΪ�����ӷ���ǿ�ᣬD���������������������;���Ľ������ʣ���B�Ļ�ѧʽ������ �� д����Ӧ�ڵ����ӷ���ʽΪ ��
��4����A��C��D���dz������壬C���γ��������Ҫ���壬��Ӧ�۵Ļ�ѧ����ʽ ��
��5����A��B��C��ˮ��Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ��DΪCO2 �� �����ӷ���ʽ����B��Һ
�Լ��Ե�ԭ�������ӷ���ʽ��ʾ�� �� �ٳ�C��һ����; ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�ag����x��bg����y�ķ�������ͬ������˵����ȷ���ǣ� ��
A.��״���£���������x��y���֮��Ϊb��a
B.ͬ��ͬѹ�£�����x������y���ܶ�֮��Ϊ b��a
C.25��ʱ��1g����x��1g����y��ԭ����֮��Ϊb��a
D.ͬ���ʵ���������x������y������֮��Ϊb��a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�������Ŀ��
��1������֮��Ϊ7��6����������CO��NO��������֮��Ϊ����ԭ����֮��Ϊ����ͬ�����µ����֮��Ϊ ��
��2������mgij���壬����˫ԭ�ӷ��ӹ��ɣ�����Ħ������ΪMgmol��1 �� �������ӵ�������NA��ʾ���ٸ���������ʵ���Ϊmol��
�ڸ���������ԭ������Ϊ����
�۸������ڱ�״���µ����ΪL��
�ܸ���������1Lˮ�У������Ƿ�Ӧ��������Һ�����ʵ���������Ϊ ��
�ݸ���������ˮ���γ�VL��Һ������Һ�����ʵ���Ũ��ΪmolL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���һ���ݻ�Ϊ5L���ܱ������У����백�����������ǵ����ʵ���֮��Ϊ1��2��������Ӧ��
4NH3+5O24NO+6H2O��g������H��0
��1���ڴﵽƽ������൱��ԭ�������1���Ķ������壬����������ݻ����䣬ƽ���ƶ��������ѹǿ���ֲ��䣬ƽ���ƶ���
��2�������¶�ƽ���ƶ���
��3�����������NH3��ת���� ��
��4��������Ӧ��һ��������2min��ﵽƽ�⣬�������NH3Ϊ2mol��NH3��ת����Ϊ20%����NO��Ũ�ȱ仯��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ �� O2��ƽ��Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ΪԪ�����ڱ���һ���֣����еı�Ŵ�������Ӧ��Ԫ�أ���ش��������⣺ 
��1�����Ԫ�صĻ�̬ԭ�ӵļ۵����Ų�ʽ�� �� ����ͬ���ڣ��һ�̬ԭ�ӵĺ���δ�ɶԵ���������Ԫ������д��Ԫ�ط��ţ���
��2���ܺ���ߺ�Ԫ���γɵ���������۵��ɸߵ��͵��� ��
��3���ٺ���ۺ�Ԫ���γɵĺ���18���ӵķ���Ϊ��д�����ƣ����÷����Тۺ�Ԫ�ص�ԭ�ӵ��ӻ���ʽΪ �� �ڡ��ܡ�������Ԫ�ص�ԭ���γɵľ��壬�侧���Ľṹ�ص���ͼ��ʾ����û�����Ļ�ѧʽΪ���ö�Ӧ��Ԫ�ط��ű�ʾ���� 
��4���±���ijЩ������Ԫ�صĵ縺��ֵ��
Ԫ�ط��� | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
�縺�� | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.1 |
��ͨ�������縺��ֵ�仯���ɣ�ȷ��N��ӽ��ĵ縺��ֵ��Χ����N�� ��
���Ʋ�縺��ֵ��ԭ�Ӱ뾶��ϵ�� ��
�����ƶϣ�AlBr3�л�ѧ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��4���������������Ԫ�ص����λ�������Ԫ��x��ԭ�Ӻ����������m��2����y��������������ԣ��ش��������⣺ 
��1��Ԫ��x�����ڱ��е�λ���ǵ����ڣ����壬�䵥�ʿɲ��õ�������ķ����Ʊ���
��2��m��n��y����Ԫ������������ˮ�����У�������ǿ���� �� ������ǿ���� �� ���ѧʽ��
��3��������ӣ�mn��2�ĵ���ʽΪ �� ��mn��2��Ϊ��±�أ�������±�����ƣ���������������Һ��Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п��һ��Ӧ�ù㷺�Ľ�����Ŀǰ��ҵ����Ҫ���á�ʪ��������ұ��п��ij��п�����Ҫ�ɷ���ZnS������������FeS�������ɷ֣�������Ϊԭ����п�Ĺ���������ͼ��ʾ�� 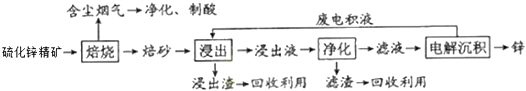
�ش��������⣺
��1����п����ı������������յķ���¯�н��У���������ɰ����Ҫ�ɷֵĻ�ѧʽΪ ��
��2�����չ����в����ĺ��������ɾ������ᣬ��������ں�����������
��3������Һ�������������м������Ҫ����Ϊ �� �������� ��
��4�������������е������������壬��������Pb��Ag�Ͻ���Ե缫�������ݳ��������� ��
��5���Ľ���пұ�����գ������ˡ���ѹ�������ȫʪ�����̣���ʡ�������¿�����Ⱦ�ı��չ��̣��ֿɻ��һ���ɹ�ҵ��ֵ�ķǽ������ʣ�����ѹ������з�����Ҫ��Ӧ�����ӷ���ʽΪ ��
��6���ҹ��Ŵ������á�������ұ��п��������Ӧ�������칤������йء�������Ǧ���ļ��أ���¯��ʯʮ�װ����һ����ڣ�����Ȼ�������ú̿����ʢ�������н������ͺ죬����������ٹ�ȡ����������ǦҲ��������п������Ҫ��Ӧ�Ļ�ѧ����ʽΪ �� ��ע��¯��ʯ����Ҫ�ɷ�Ϊ̼��п����Ǧ��ָ����п����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com