
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol·L-1和2 mol·L-1,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO)( )
A.0.448 L B.0.672 L
C.0.896 L D.0.224 L
科目:高中化学 来源: 题型:
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
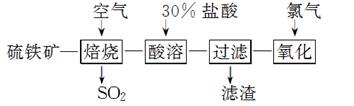
FeCl3·6H2O(晶体粗品)
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)??2SO3(g),该反应的平衡常数表达式为K=____;过量的SO2与NaOH溶液反应的化学方程式为________________________________________________________________________。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是________________________、________________________________________________________________________。
(3)通氯气氧化时,发生的主要反应的离子方程式为________________________________;
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为_______________________。
(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列说法正确的是( )
A.34S原子核内中子数为16
B.16O2比18O2沸点更低
C.2H+的酸性比1H+的酸性更强
D.13C和15N原子核内的质子数相差2
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车排放的尾气中含有NO2,NO2是城市大气污染的主要污染物之一,在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2—→2NO+2O,②2NO+O2—→2NO2,③O+O2—→O3。下列对该反应过程及生成物叙述正确的是( )
A.NO2起催化剂作用 B.NO起催化剂作用
C.NO2只起氧化剂作用 D.O3与O2为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关硝酸化学性质的叙述中,正确的是( )
A.浓、稀硝酸都能使蓝色石蕊试纸最终变为红色
B.硝酸能与FeO反应,只表现氧化性
C.硝酸可与Na2S反应制得H2S气体
D.浓硝酸因分解放出的NO2又溶解于硝酸而呈黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组同学设计如下图所示装置探究氨气的还原性。
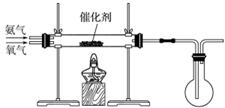
(1)氨催化氧化的化学方程式为_______________________________________________。
(2)若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为__________。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。请选择合适的方案并说明原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
2014高考涉及氮及化合物选项正误判断,正确的划“√”,错误的划“×”
(1)Cu溶于稀HNO3的离子方程式为Cu+2H++NO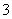 ===Cu2++NO2↑+H2O( )
===Cu2++NO2↑+H2O( )
(2014·江苏,7A)
(2)NH3、O2和HNO3三种物质中,任意两种物质在一定条件下均能发生反应( )
(2014·江苏,8B)
(3)NH3能使酚酞溶液变红,因而NH3可用于设计喷泉实验( )
(2014·广东理综,9C)
(4)将可调高度的铜丝伸入稀HNO3中,溶液变蓝,则Cu与稀HNO3发生置换反应( )
(2014·广东理综,22C)
(5)实验室用锌粒、稀HNO3以及试管、带导管的橡皮塞可制取H2( )
(2014·安徽理综,9C)
(6)由于反应物浓度越大,反应速率越快,因而常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完( )
(2014·安徽理综,12B)
(7)制二氧化氮时,用水或NaOH溶液吸收尾气( )
(2014·天津理综,2D)
(8)用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2( )
(2014·重庆理综,2B)
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-===2NO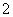 +H2O
+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃

(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、______、______。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是________________________________________________________________________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是__________________________________
________________________________________________________________________。
②装置E的作用是___________________________________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________________________________________________________________
________________。如果没有装置C,对实验结论造成的影响是________________________________________________________________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是 ( )
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com