


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| ||
| ||
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(13分)已知NaHSO3溶液显酸性,而Na2SO3溶液显碱性。
(1)25℃时,在20.0mL0.5mol·L-1的NaOH溶液中,通入标准状态下的224mLSO2,所得溶液显______(填“酸”或“碱”)性,原因是_______________________________(用 化学用语表达),溶液中所含有的离子浓度由大到小的顺序为____________________。
(2)在上述溶液中逐滴加入1mol·L-1NaClO溶液至20mL,反应的离子方程式为____________________。当滴加NaClO至10mL时,溶液中由水电离的H+离子浓度为______________mol·L-1。滴加至20mL时溶液中离子浓度由大到小的顺序为_________________________。
(3)若在(2)反应后的溶液中滴加少量甲基橙,溶液显_________色。
查看答案和解析>>
科目:高中化学 来源:09~10学年浠水一中高二下学期期中考试化学卷 题型:填空题
(13分)已知NaHSO3溶液显酸性,而Na2SO3溶液显碱性。
(1)25℃时,在20.0mL0.5mol·L-1的NaOH溶液中,通入标准状态下的224mLSO2,所得溶液显______(填“酸”或“碱”)性,原因是_______________________________(用 化学用语表达),溶液中所含有的离子浓度由大到小的顺序为____________________。
(2)在上述溶液中逐滴加入1mol·L-1NaClO溶液至20mL,反应的离子方程式为____________________。当滴加NaClO至10mL时,溶液中由水电离的H+离子浓度为______________mol·L-1。滴加至20mL时溶液中离子浓度由大到小的顺序为_________________________。
(3)若在(2)反应后的溶液中滴加少量甲基橙,溶液显_________色。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省厦门市毕业班适应性考试理综化学试卷(解析版) 题型:填空题
(1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”。
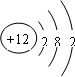
①M的原子结构示意图为______。
②以M、Al为电极,KOH溶液为电解质溶液,则负极的电极反应式为______。
(2)淬火是将金属工件加热到某温度,随即浸入淬冷介质中快速冷却的金属热处理工艺。
①使用水进行淬火,若生成磁性氧化铁,该反应的化学方程式为____________
②验证铁用水淬火后的固体产物是否存在+3价的铁,可选用的试剂为_______ (填序号)
A.H2O2溶液 B.铜粉 C.稀硫酸 D.KMnO4溶液
(3)髙铁酸钾在水中的反应为4FeO42—+10H2O 4Fe(OH)3+8OH—+3O2
4Fe(OH)3+8OH—+3O2
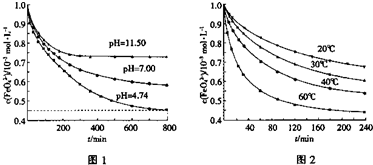
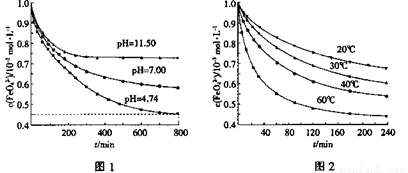
①图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况。pH =4.74时,反应从开始到800min的平均反应速率v(FeO42—)=______ (保留两位有效数字)。
②图1在800min后,三种溶液中K2FeO4的浓度均不再改变。观察图1判断随着pH 变大,此反应的平衡常数______(填“变大”、“变小”或“不变”)。
③图2在240min后,四种溶液中K2FeO4的浓度均不再改变,则上述反应的反应热 △H______0(填“>”、“<”、“=”)。
查看答案和解析>>
科目:高中化学 来源:09-10学年浠水一中高二下学期期中考试化学卷 题型:填空题
(13分)已知NaHSO3溶液显酸性,而Na2SO3溶液显碱性。
(1)25℃时,在20.0mL0.5mol·L-1的NaOH溶液中,通入标准状态下的224mLSO2,所得溶液显______(填“酸”或“碱”)性,原因是_______________________________(用 化学用语表达),溶液中所含有的离子浓度由大到小的顺序为____________________。
(2)在上述溶液中逐滴加入1mol·L-1NaClO溶液至20mL,反应的离子方程式为____________________。当滴加NaClO至10mL时,溶液中由水电离的H+离子浓度为______________mol·L-1。滴加至20mL时溶液中离子浓度由大到小的顺序为_________________________。
(3)若在(2)反应后的溶液中滴加少量甲基橙,溶液显_________色。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com