
����Ŀ������������գ�
��1������FeCl3��Һʴ��ͭ�������·��Ĺ����У���Һ������Fe2+��Fe3+��Cu2+����������Դ���պ������壮�������洦���������ش��������⣺ 
�Լ�2�� �� ����B�� �� ͨ��������C�� �� ���ѧʽ����
��2��д�������Լ�1������Ӧ�����ӷ���ʽ���� ��
��3�����ۺ����ú�ˮ�����Ʊ�ʳ�Ρ��������þ�����ʣ�����������ͼ��ʾ�� 
��Ӧ�٩����У�����������ԭ��Ӧ����������ţ���
��4��д����Ӧ�ڵ����ӷ���ʽ ��
��5��X��Һ�е���Ҫ��������Na+�� ��
��6�������к���Na2SO4��MgCl2��CaCl2�ȿ��������ʣ�Ϊ�Ƶô�����NaCl���壬�������£����ܽ⣻�����μ��������BaCl2��Һ��NaOH��Һ��Na2CO3��Һ�������ܼ�������������벹ȫȱ�ٵ�ʵ�鲽�裩��
��7�����鴿����Ʒ���Ƿ�NaClӦѡ�õ��Լ��� ��
���𰸡�
��1��HCl�� Cu�� Cl2
��2��Fe+2Fe3+=3Fe2+�� Fe+Cu2+=Fe2++Cu
��3����
��4��Mg��OH��2+2H+=Mg2++2H2O
��5��NH4+
��6�����ˣ������ᾧ
��7��ϡ���ᡢAgNO3��Һ
���������⣺�����÷�Һ����FeCl3��ʴҺ��Ӧ��ȥ��Һ�е�Cu2+����Һ�������Fe��Ӧ�û���Cu�����ˣ�����AΪCu��Fe�Ļ�����Һ������ΪFeCl2������A�����ᷴӦ����FeCl2�����˳�ȥCu��FeCl2�����������õ�FeCl3����1��������������֪���Լ�2��HCl������B��Cu��ͨ�������C��Cl2��
���Դ��ǣ�HCl��Cu��Cl2����2�������Լ�1������Ӧ�����ӷ���ʽ��Fe+2Fe3+=3Fe2+��Fe+Cu2+=Fe2++Cu��
���Դ��ǣ�Fe+2Fe3+=3Fe2+��Fe+Cu2+=Fe2++Cu��
����ˮ����Ũ������ȴ�ᾧ�õ����κ�ĸҺ����ĸҺ�м���Ca��OH��2��������ӦMg2++2OH��=Mg��OH��2�������˵õ�Mg��OH��2��������Mg��OH��2����ϡ�����з�����ӦMg��OH��2+2HCl=MgCl2+2H2O������Һ����Ũ������ȴ�ᾧ�õ�MgCl2.6H2O����MgCl2.6H2O������HCl��Χ�м��ȵõ�����
MgCl2����������Ȼ�þ�õ�Mg��������ӦΪMgCl2 ![]() Mg+Cl2����
Mg+Cl2����
�������ᴿ�õ�NaCl��Һ������Һ��ͨ�백���Ͷ�����̼��������ӦNaCl+NH3+CO2+H2O=NaHCO3+NH4Cl��̼�������ܽ��С��NaCl�����������Եõ���ҺXΪNH4Cl��Һ����NaHCO3���ȷ�����Ӧ2NaHCO3 ![]() Na2CO3+CO2��+H2O�����õ�̼���ƹ��壬��3����ʯ�������Ȼ�þ��Ӧ����������þ�������Ȼ��ƣ�Ԫ�ػ��ϼ۲��䣬��������ԭ��Ӧ��
Na2CO3+CO2��+H2O�����õ�̼���ƹ��壬��3����ʯ�������Ȼ�þ��Ӧ����������þ�������Ȼ��ƣ�Ԫ�ػ��ϼ۲��䣬��������ԭ��Ӧ��
��������þ���������ᷴӦ�����Ȼ�þ��ˮ��Ԫ�ػ��ϼ۲��䣬��������ԭ��Ӧ��
���Ȼ�þ��Һ����Ũ���õ��Ȼ�þ���壬Ԫ�ػ��ϼ۲��䣬��������ԭ��Ӧ��
���Ȼ�þ����ֽ�õ��Ȼ�þ��ˮ��Ԫ�ػ��ϼ۲��䣬��������ԭ��Ӧ��
�ݵ���Ȼ�þ�õ�þ��������Ԫ�ػ��ϼ۷����仯��������ԭ��Ӧ��
��ѡ�ݣ�
���Դ��ǣ��ݣ���4��������þ���������ᷴӦ�����Ȼ�þ��ˮ������ʽΪ��Mg��OH��2+2HCl=MgCl2+2H2O�����ӷ���ʽΪ��Mg��OH��2+2H+=Mg2++2H2O��
���Դ��ǣ�Mg��OH��2+2H+=Mg2++2H2O����5�����Ȼ�����Һ������ͨ�백����������̼��������Ӧ��NH3+CO2+H2O=NH4HCO3��NH4HCO3+NaCl=NH4Cl+NaHCO3����������Һ�к���NH4Cl��NaHCO3������Һ�е���Ҫ��������Na+��NH4+��
���Դ��ǣ�NH4+����6������Ҫ�Ѵ�������ˮ�γ���Һ��Ȼ��þ���������������ӳ���������������������ƿ��Խ�þ���ӳ���������������ñ����ӳ���������������Ȼ������Խ���������ӳ����������ȳ�þ���ӣ������ȳ���������Ӷ��У���������̼������ӳ������������Ӽ���̼����ת��Ϊ������Ca2++CO32��=CaCO3�������Ǽ����̼����Ҫ���ڼ�����Ȼ���֮������̼���ƻ��ȥ��Ӧʣ����Ȼ�����Ba2++CO32��=BaCO3�������Ӷ������ˣ��ٽ��й��ˣ�����ټ��������ȥ��Ӧʣ������������Ӻ�̼������ӣ�������������õ��ϴ������Ȼ��ƣ�
���Դ��ǣ����ˣ������ᾧ����7���������ܺ������ữ����������Һ��Ӧ�����Ȼ�����ɫ���������Լ��鴿����Ʒ���Ƿ�NaClӦѡ�õ��Լ���ϡ���ᡢAgNO3��Һ��
���Դ��ǣ�ϡ���ᡢAgNO3��Һ��


 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��A��B��C��D�ֱ�λ��������ͬ�����ڣ���ԭ��������������ֻ��DΪ����Ԫ�أ����ǿ��γ�x��y��z��w���ֳ����Ķ�Ԫ�����Pp��q���ֳ�����Ԫ���������֮���������ת����ϵ����x ![]() p
p ![]() q+z����y
q+z����y ![]() p+O2��������zΪҺ�塢wΪ���壬�����Ϊ���壮�����й�˵����ȷ���ǣ� ��
p+O2��������zΪҺ�塢wΪ���壬�����Ϊ���壮�����й�˵����ȷ���ǣ� ��
A.ԭ�Ӱ뾶��С˳��D��C��B��A
B.y��p �о�ֻ�������Ӽ�
C.B��D��Ԫ������������Ӧˮ����ֱ�Ϊǿ�ᡢǿ��
D.p������ˮ�ĵ����q�ܴٽ�ˮ�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£�amL������̬��������Ȼ�Ϻ�����O2��ϵ�ȼ���ָ���ԭ״̬��������������С2a mL��������CO2���ܽ⣩�������������ܵ���ϣ� ��
A.C2H4��CH4��C3H4
B.CH4��C3H6��C2H2
C.C2H6��C3H6��C4H6
D.C3H8��C4H8��C4H6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����X��Al2O3��Fe2O3��Cu��SiO2�е�һ�ֻ���������ɣ�ijУ������ȤС��������;���ֱ��X��������ʵ��̽���������й�˵������ȷ���ǣ������� 
A.�ɹ���֪X��һ������Fe2O3��Cu
B.���жϻ�������Ƿ���Al2O3
C.1.92 g����ɷ�ΪCu
D.ԭ�������m�� Fe2O3����m��Cu��=1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D���ֽ�����Ͷ��ˮ��ֻ��D��Ӧ�ų���������AͶ��C������Һ�п��û�������C��B������������ˮ������Ա�A������������ˮ�������ǿ�������ֽ����Ľ�����ǿ��˳����ȷ���ǣ� ��
A. A��B��C��DB. D��A��B��C
C. D��B��A��CD. D�� C��A��B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȷ�Ӧ������һ����Ҫ���ʣ���������;ʮ�ֹ㷺�������ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â����ֽ©�����²����մ���������������ɳ�С�����֪��Al��Al2O3��Fe��Fe2O3���۵㡢�е����������
���� | Al | Al2O3 | Fe | Fe2O3 |
�۵�/�� | 660 | 2 054 | 1 535 | 1 462 |
�е�/�� | 2 467 | 2 980 | 2 750 | �� |
��1��I��ijͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������ǣ��÷�Ӧ�ų�������ʹ���ۻ����������۵�����ͣ���ʱҺ̬���������ۺ��γ������Ͻ�����Ϊ���Ľ����Ƿ���������������������������
��2�����һ����ʵ�鷽����֤���������õĿ�״�������к��н���������ʵ�������Լ��� �� ��Ӧ�����ӷ���ʽΪ ��
��3��ʵ�����ܽ��������������Լ��������˵��Լ���������ţ���
A.Ũ����
B.ϡ����
C.ϡ����
D.����������Һ
��4����ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�ͣ�ijͬѧȡһ������������������һ������ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һ�У���μ���6molL��1������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���Իش��������⣺ 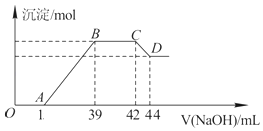
�����⣬��д���������������ϡ�����ᷴӦ�����ӷ���ʽ��
��5��ͼ��OA��û�г������ɣ��˽η�����Ӧ�����ӷ���ʽΪ ��
��6����BC�Σ����������ʵ���û�б仯����˽η�����Ӧ�����ӷ���ʽΪ��
��7������������Ԫ�ص����ʵ���Ϊmol��
��8��B���Ӧ�ij��������ʵ���Ϊmol��A���Ӧ������������Һ�����ΪmL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Բ���A��������Ԫ����ɵĻ����ij�о�С�鰴��ͼ����̽������ɣ� 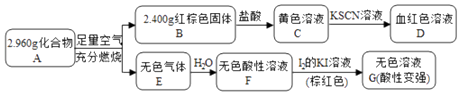
��ش�
��1��A�Ļ�ѧʽΪ �� A��������B��E�Ļ�ѧ����ʽΪ ��
��2����ҺC���ܽ�ͭƬ����Ӧ�����ӷ���ʽΪ �� ���ٸ÷�Ӧ��һ��ʵ��Ӧ����
��3����֪������A����ϡ���ᷴӦ������һ�ֵ���ɫ�������һ�����壨����µ��ܶ�Ϊ1.518g/L������������ӵĵ���ʽΪ �� �÷�Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ�У����������ӷ���ʽH++OH-��H2O��ʾ����
A. 2NaOH + H2SO4 = Na2SO4+2H2O
B. Ba��OH��2+2HCl = BaCl2+2H2O
C. Cu��OH��2+ 2HNO3=Cu��NO3��2+2H2O
D. KOH+ HCl = KCl+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڷǵ���ʵ���( )
A. NH3 B. (NH4)2SO4 C. Cl2 D. CH3COOH
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com