
【题目】(1)1807年,英国化学家戴维在研究中发现:电解条件下可把水分解成H2和O2。他设想用电解的方法从KOH、NaOH中分离出K和Na。最初,戴维用饱和KOH溶液进行电解,不料还是得到H2和O2。这时,他考虑在无水条件下继续这项实验,但是,实验中产生的金属液珠一接触空气就立即燃烧起来;这时,他又考虑在________条件下电解熔融的KOH继续实验,最后他终于成功地得到了银白色的金属钾。
(2)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,质量数是85。根据材料回答下列问题:
Ⅰ.铷位于元素周期表的第________周期________族。
Ⅱ.关于铷的下列说法中正确的是________(填序号,下同)。
①与水反应比钠更剧烈 ②Rb2O在空气中易吸收水和二氧化碳 ③Rb2O2与水能剧烈反应并释放出O2④它是极强的还原剂 ⑤RbOH的碱性比同浓度的NaOH弱
Ⅲ.现有铷和另一种碱金属形成的合金5g,与足量水反应时生成标准状况下的气体2.24 L,则另一碱金属可能是________(填元素符号)。
【答案】隔绝O2 五 ⅠA .①②③④ Na或Li
【解析】
(1)有水或氧气存在的条件下,钾会被氧化,需要隔绝氧气;
(2)Ⅰ.Rb是碱金属的37号元素,位于K的下面,核电荷数为19,有四个电子层,最外层有1个电子,它位于第五周期ⅠA族;
Ⅱ.Rb的结构性质与Na相似,且更活泼,对应的Rb2O、Rb2O2、RbOH的性质分别与Na2O、Na2O2、NaOH相似,其金属性强于钠,所以碱性:RbOH大于NaOH,所以选①②③④;
Ⅲ.从碱金属与水反应通式2R+2H2O=2ROH+H2↑可知,生成0.1 mol H2,碱金属的物质的量为0.2 mol,所以合金的平均摩尔质量M=![]() =25 g·mol-1,而M(Rb)>25 g·mol-1,则另一碱金属的M必小于25 g·mol-1,所以可能是Na或Li。
=25 g·mol-1,而M(Rb)>25 g·mol-1,则另一碱金属的M必小于25 g·mol-1,所以可能是Na或Li。


科目:高中化学 来源: 题型:
【题目】25℃时,体积均为V0且pH相同的MOH与ROH溶液,分别加水稀释至V,pH随![]() 变化如图所示。下列说法正确的是( )
变化如图所示。下列说法正确的是( )
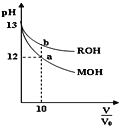
A.MOH为一元强碱
B.a点溶液的导电性大于b点溶液
C.原溶液中:c(MOH)=c(ROH)
D.水的电离程度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H 前者小于后者的是
①C(s)+O2(g)═CO2(g)△H1 C(s)+![]() O2═CO(g)△H2
O2═CO(g)△H2
②S(g)+O2(g)═SO2(g)△H3 S(s)+O2(g)═SO2(g)△H4
③2H2(g)+O2(g)═2H2O(l)△H5 H2(g)+![]() O2(g)═H2O(l)△H6
O2(g)═H2O(l)△H6
④CaCO3(s)═CaO(s)+CO2(g)△H7 CaO(s)+H2O(l)═Ca(OH)2(s)△H8
A.①④B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:

(1)从反应开始到10 s,用Z表示的反应速率为____________。X的物质的量浓度减少了___________________,Y的转化率为_____________________。
(2)该反应的化学方程式为:_________________________________。
(3)若要使反应时间缩短,可使用下列哪些方法_____________。
A.升高温度
B.增大容器的体积
C.通入He气增大容器的压强
D.加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芝加哥伊利诺伊大学的研究人员设计了一种可用于商业化的新型锂金属电池,电池结构如图所示: 电池工作时,下列说法错误的是
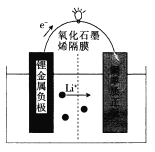
A. 该装置将化学能转化为电能
B. 负极上发生的电极反应为Li- e-= Li+
C. 该电池可用LiOH溶液作电解质
D. 电池工作时,电路中每流过1 mol电子,正极增重7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种新型能源,氢氧燃料电池的能量转化效率高。某学习小组设计如图A所示的氢氧燃料电池装置,电流由石墨极(C极)经外电路流向铂极(Pt极)。
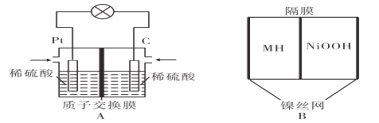
请回答下列问题:
(1)向图A装置中充入氢气的一极是____(填“铂极”或“石墨极”),电子流向是________
(2)A装置在能量转化过程中,负极的电极反应式为________
(3)若A装置消耗11.2L氧气(标准状况),理论上有____molH+从交换膜________侧向________侧迁移(填“左”或“右”)。
(4)某金属合金是优质储氢材料,金属氢化物镍电池(MH-Ni电池)具有广泛应用价值。如图B以KOH为电解质,电池反应为NiOOH+MH![]() Ni(OH)2+M。在放电时正极的电极反应式为________。
Ni(OH)2+M。在放电时正极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多尺度复杂化学系统模型可以用量子化学计算小区间内(如生物固氮时固氮酶中)的化学反应。
(1)固氮酶有铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯。
①乙炔是__________(填“非极性”或“极性”)分子。
②碳负离子CH3-的立体构型为____________。
③根据等电子原理,NO+的电子式为________________。
(2)钒可用于合成电池电极,也可用于人工合成二价的钒固氮酶(结构如图a)。
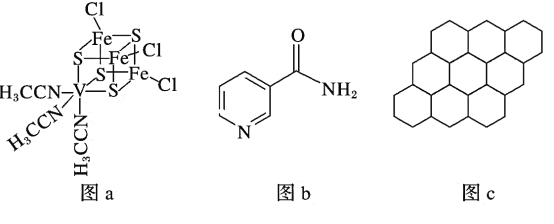
①V2+基态时核外电子排布式为____________________________________________。
②钒固氮酶中钒的配位原子有_____________________________(填元素符号)。
(3)烟酰胺(结构如图b)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有_______________________,1 mol该分子中含σ键的数目为________。
(4)12 g石墨烯(结构如图c)中含有的正六边形数目约为________;请你预测硅是否容易形成类似石墨烯的结构,并说明理由:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为我国圆明园兽首铜像—兔首和鼠首,看上去仍熠熠生辉。下列对其原因的分析最可能的是( )

A.它们表面的铜绿已用酸性溶液洗去B.利用电镀原理在其表面镀了一层耐腐蚀的黄金
C.铜的活动性很弱,与空气成分不反应D.它们是含一定比例金、银、锡、锌的铜合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建造舰船需要大量的新型材料,舰船的甲板也要耐高温且外壳要耐腐蚀,而镍铬铁合金就是具有高强度、耐高温、耐腐蚀等优良性能的特种钢,这类特种钢中含有碳、硅、氧、氮、磷等元素。
(1)保铬钢抗腐蚀性能强,![]() 基态原子的价电子排布_________,为铬元素在周期表中_________区。
基态原子的价电子排布_________,为铬元素在周期表中_________区。
(2)![]() 能形成多种配离子,如
能形成多种配离子,如![]() 、
、![]() 和
和![]() 等,
等,![]() 中心原子的配位数是_________,与
中心原子的配位数是_________,与![]() 互为等电子体的分子为_________。
互为等电子体的分子为_________。
(3)舰船甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中![]() 原子杂化方式为________杂化。
原子杂化方式为________杂化。
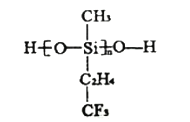
(4)碳和硅可化合成碳化硅,![]() 晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的,但是碳化硅的熔点低于金刚石,原因是_________。
晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的,但是碳化硅的熔点低于金刚石,原因是_________。
(5)铁的氧化物之一是![]() ,从
,从![]() 中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?________(填“是”或“否”);该立方体是不是
中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?________(填“是”或“否”);该立方体是不是![]() 的晶胞?_________(填“是”或“否”);立方体中铁离子处于氧离子围成的_________(填空间结构)空隙;根据上图计算
的晶胞?_________(填“是”或“否”);立方体中铁离子处于氧离子围成的_________(填空间结构)空隙;根据上图计算![]() 晶体的密度为_________
晶体的密度为_________![]() 。(图
。(图![]() ,计算结果保留两位有效数字)
,计算结果保留两位有效数字)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com