
| A. | 与28 gCO具有相同分子数的C2H4的质量一定是28 g | |
| B. | 1 molAl 3+含有的核外电子数为3NA | |
| C. | 常温常压下,1 mol甲烷含有的原子数为5NA | |
| D. | 常温常压下,1 molL氢气的体积大于22.4 L |
分析 A.乙烯与一氧化碳具有相同的摩尔质量,依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$判断;
B.1个铝离子含有10各 电子;
C.1个甲烷分子含有5个原子;
D.常温常压下,Vm>22.4L/mol;
解答 解:A.乙烯与一氧化碳具有相同的摩尔质量,依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$可知,二者分子数之比等于质量之比,故A正确;
B.molAl 3+含有的核外电子数为30NA,故B错误;
C.1个甲烷分子含有5个原子,1 mol甲烷含有的原子数为5NA,与温度压强无关,故C正确;
D.常温常压下,Vm>22.4L/mol,所以常温常压下,1 molL氢气的体积大于22.4 L,故D正确;
故选:B.
点评 本题考查了阿伏伽德罗常数及相关计算,熟悉以物质的 量为核心的计算公式,明确相关物质的结构组成是解题关键,题目难度不大.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:解答题
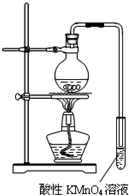 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水洗涤2~3次后再使用 | |
| B. | 用滤纸擦干后才可使用 | |
| C. | 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用 | |
| D. | 用盐酸洗涤后,经蒸馏水冲洗,方可使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

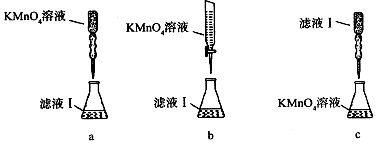
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯酸钾是还原剂 | |
| B. | KCl既是氧化产物,又是还原产物 | |
| C. | 反应中消耗3mol P时,转移电子的物质的量为15mol | |
| D. | 发令时产生的白烟只是KCl固体颗粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 夜里的月色本身就很美 | |
| B. | 空气中的小水滴颗粒直径约为1nm-100nm | |
| C. | 光线是一种胶体 | |
| D. | 雾是一种胶体,能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
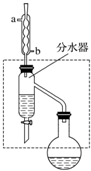 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com