
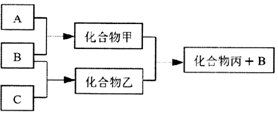
 如图所示转化关系中A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成.其中单质B含共用电子对数最多,甲和丙分子中均含有10个电子.下列说法错误的是( )
如图所示转化关系中A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成.其中单质B含共用电子对数最多,甲和丙分子中均含有10个电子.下列说法错误的是( )| A. | Z元素位于第二周期第VIA族 | |
| B. | 可用排水法收集化合物乙 | |
| C. | 元素X、Y、Z的原子半径大小关系为X<Z<Y | |
| D. | 化合物甲溶于化合物丙中,存在的微粒有5种 |
分析 单质B含共用电子对数最多,应为N2,甲和丙分子中均含有10个电子,则甲为NH3,可知A为H2,化合物甲、乙生成化合物丙和氮气,则丙含有H元素,为氢化物,且10个电子,应为H2O,则C为O2,化合物乙为NO,则X为H元素、Y为N元素,Z为O元素,结合对应单质、化合物的性质以及题目要求解答该题.
解答 解:A.由以上分析可知Z为O元素,位于第二周期第VIA族,故A正确;
B.乙为NO,不溶于水,可用排水法收集,故B正确;
C.X为H元素、Y为N元素,Z为O元素,原子半径大小为X<Z<Y,故C正确;
D.甲为NH3,对应的水溶液中存在NH3、NH3•H2O、H2O、NH4+、H+、OH-等粒子,故D错误.
故选D.
点评 本题考查无机物的推断,为高频考点,题目难度中等,推断元素与物质是解题的关键,注意掌握常见10电子物质,利用猜测验证法进行推断,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 乳酸[CH3CH(OH)COOH]有一对对映异构体,因为其分子中含有一个手性碳原子 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | SiCl4的分子中硅氯键的极性比CCl4中的碳氯键强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,水电离出的c(H+)=1×10-12 mol/L的溶液中不可能大量存在:Al3+、NH4+、Cl-、S2- | |
| B. | 加入铝粉能产生H2的溶液中可能大量存在:Na+、Cl-、S2-、SO32- | |
| C. | 过量铁粉与稀HNO3反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 向AlCl3溶液中滴入大量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
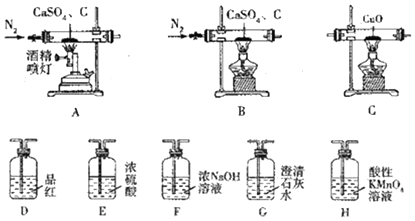
| 实验前 | 实验后 | |
| 实验1 | 装置C硬质玻璃管连同CuO质量为26.80g | 装置C硬质玻璃管连同反应后固体质量为26.64g |
| 实验2 | 装置G连同溶液质量为187.50g | 装置G连同反应后溶液及沉淀的质量为188.38g |
| 实验3 | 装置D、H连同溶液质量和为373.60g | 装置D、H连同溶液质量和为374.24g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:b>c>d | |
| B. | 气态氢化物稳定性:a>c | |
| C. | 简单阴离子还原性:d>c | |
| D. | ab可形成既含离子键又含共价键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中,KMnO4是还原剂 | |
| B. | 该反应中,C元素被氧化 | |
| C. | 通过该反应可知,氧化性:KMnO4>CO2 | |
| D. | 该反应每转移1mol电子,同时生成1molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
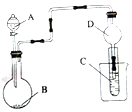
| A. | 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中产生白色沉淀,白色沉淀不会消失 | |
| B. | 实验仪器D可以起到防止溶液倒吸的作用 | |
| C. | 若A为浓盐酸,B为MnO2,C中盛石蕊溶液,则C中溶液先变红后褪色 | |
| D. | 若A为浓盐酸,B为贝壳,C中盛有硅酸钠溶液,则C中出现白色沉淀可证明酸性的强弱为:碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com