
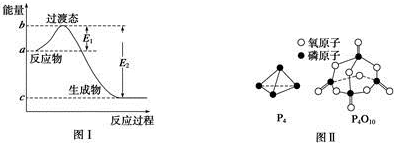
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
分析 (1)加入催化剂能降低反应所需的活化能,但是不改变反应物的总能量和生成物的总能量,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(2)依据热化学方程式,利用盖斯定律进行计算;
(3)白磷燃烧的方程式为P4+5O2=P4O10,根据化学键的断裂和形成的数目进行计算.
解答 解:(1)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1,
故答案为:减小;不变;NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1;
(2)利用盖斯定律进行计算,
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知 ③H2O(g)=H2O(l)△H=-44kJ/mol
依据盖斯定律计算②×3-①×2+③×2得到CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-764.7KJ/mol;
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-764.7KJ/mol;
(3)白磷燃烧的方程式为P4+5O2=P4O10,1mol白磷完全燃烧需拆开6mol P-P、5mol O=O,形成12molP-O、4mol P=O,
所以12mol×bkJ/mol+4mol×xkJ/mol-(6mol×a kJ/mol+5 mol×c kJ/mol)=dkJ/mol,
x=$\frac{6a+5c+d-12b}{4}$kJ/mol,
故答案为:$\frac{6a+5c+d-12b}{4}$.
点评 本题考查热化学方程式的书写方法和计算应用,注意焓变计算和物质聚集状态的标注,学习中要准确把握,另外注意反应热的计算,特别是注意分析白磷的氧化磷的分子结构,正确判断共价键的类型和数目,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属与非金属元素形成的化合物一定是离子化合物 | |
| B. | 干冰气化过程中只需克服分子间作用力 | |
| C. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| D. | 常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维做通讯材料有许多优点,但怕腐蚀,铺设也很不方便 | |
| B. | 新型无机非金属材料具有光学特性、生物功能、电学特性、耐高温、强度高 | |
| C. | 高温结构陶瓷比金属材料具有许多优点,如耐高温不怕氧化、密度小等优点 | |
| D. | 光导纤维除用于通信外,还可以用于医疗、信息处理等许多方面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
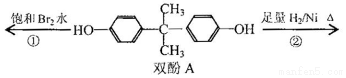
| A. | 双酚A的分子式是C15H16O2 | |
| B. | 反应①中,1mol双酚A最多消耗2mol Br2 | |
| C. | 反应②的产物中只有一种官能团 | |
| D. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
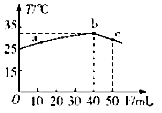 25℃时,向盛有50mLpH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示,下列叙述正确的是( )
25℃时,向盛有50mLpH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示,下列叙述正确的是( )| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | c点表示酸碱恰好完全反应 | |
| C. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 | |
| D. | 等浓度的NaOH和NaA 混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
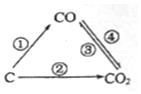 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
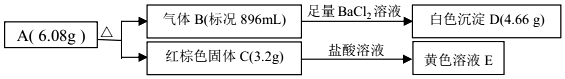
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com