
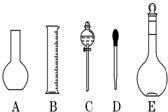
分析 (1)依据配制溶液体积选择合适容量瓶规格;依据容量瓶构造及使用方法解答;
(2)依据m=CVM需要溶质的质量;
(3)实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签据此解答;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)配制1mol/L的NaOH溶液200mL,实验室没有200mL容量瓶,应选择250mL容量瓶,容量瓶标有:温度、容量、刻度线,容量瓶带有活塞,使用过程中需要上下颠倒,所以使用前应检查是否漏水;
故答案为:250mL,温度,容量,刻度线,检漏;
(2)配制1mol/L的NaOH溶液200mL,实验室没有200mL容量瓶,应选择250mL容量瓶,实际配制250mL溶液,需要溶质的质量=1mol/L×40g/mol×0.25L=10.0g;
故答案为:10.0g;
(3)实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签;
定容的正确操作:向容量瓶中加入蒸馏水至液面离刻度线1-2cm时时,改用胶头滴管加蒸馏水至凹液面最低处与刻度线相切;
故答案为:溶解,转移,洗涤,离刻度线1-2cm时,胶头滴管,凹液面最低处与刻度线相切;
(4)A.称量药品时时间过长,导致氢氧化钠吸收空气中的水和二氧化碳,实际称量的氢氧化钠物质的量偏小,溶液浓度偏小;
B.溶解时有溶液溅出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏小;
C.溶液未冷却就定容,冷却后溶液体积偏小,溶液浓度偏大;
D.容量瓶没有进行干燥,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变;
故答案为:A 偏小 B 偏小 C 偏大 D 无影响;
点评 本题考查了一定物质的量浓度溶液配制,明确配制原理和操作步骤是解题关键,注意依据C=$\frac{n}{V}$进行误差分析.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
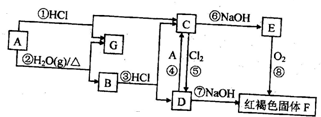
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙中CO的体积分数相同 | |
| B. | 达到平衡时,甲用时间比乙短 | |
| C. | 甲中CO2的转化率比乙高 | |
| D. | 若甲、乙中都再充入同量的氦气,平衡均不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
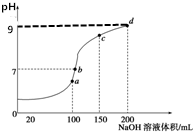 室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值与NaOH溶液体积的关系曲线如图所示(忽略溶液混合时的体积变化),下列判断不正确的是( )
室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值与NaOH溶液体积的关系曲线如图所示(忽略溶液混合时的体积变化),下列判断不正确的是( )| A. | a点所示的溶液中:c(Na+)=c(SO42-)>c(NH4+) | |
| B. | b点所示的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| C. | c点所示的溶液中:c(Na+)+c(NH4+)=2c(SO42-) | |
| D. | d点所示的溶液中:c(NH4+)+10-9mol•L-1=$\frac{{K}_{w}}{1{0}^{-9}}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2CO3溶液处理水垢中的不溶物:CaSO4(s)+CO${\;}_{3}^{2-}$(aq)=CaCO3(s)+SO${\;}_{4}^{2-}$ | |
| B. | 将Na2S溶液在空气中长期放置变浑浊:2S2-+O2+4H+=2S+2H2O | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO${\;}_{3}^{-}$+Ca2++2OH-=CaCO3↓+2H2O | |
| D. | 向Fe(NO3)3溶液中通入过量SO2:2Fe3++SO2+2H2O=2Fe2++SO${\;}_{4}^{2-}$+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制各铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制各铝的工艺流程:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com